بخش 2 فصل ۲ آموزش خط به خط شیمی یازدهم شامل موارد زیر می باشد:
- جاری شدن انرژی گرمایی
- واکنش های گرماده و گرماگیر
- مبادلۀ گرما بر اثر انجام واکنش در دمای ثابت
- عوامل مؤثر بر گرمای واکنش
- آنتالپی
- مسائل استوکیومتری ΔH
6- جاری شدن انرژی گرمایی | تدریس خصوصی شیمی
| دانلود جزوه تمامی فرمول های شیمی |
به بخشی از جهان که برای مطالعه، انتخاب و تغییر انرژی آن بررسی می شود، سامانه یا سیستم می گویند. هر چیزی که در پیرامون سامانه باشد، محیط نامیده می شود. در حقیقت بقیۀ جهان هستی، محیط پیرامون سامانه است؛ اما در عمل کافی است تنها بخشی که با سامانه در ارتباط است را محیط در نظر بگیریم.
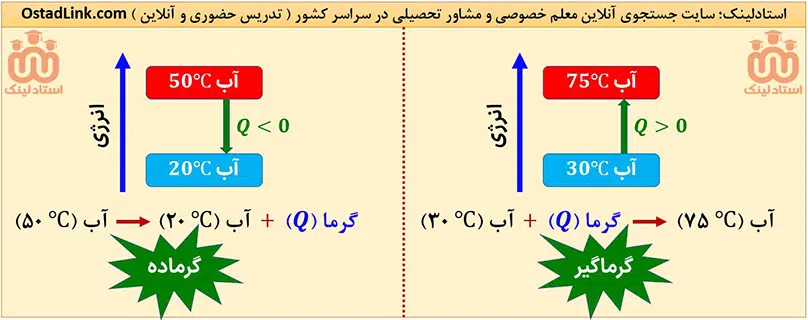
مثال: اگر ظرف آبی با دمای 50 درجه سانتی گراد درون اتاقی یا دمای 20 درجۀ سانتی گراد قرار داشته باشد، ظرف آب سامانه ( سیستم ) و اتاق، محیط محسوب می شود.
توجه داشته باشید که یکی از راه های تغییر انرژی یک سامانه و به دنبال آن مبادلۀ انرژی بین سامانه و محیط، انتقال گرما است.
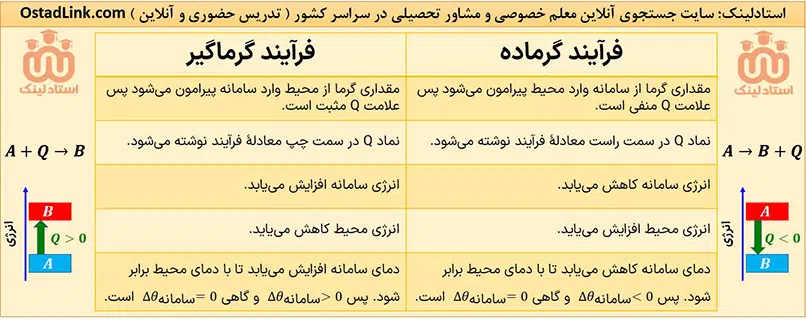
نکته: اگر دمای سامانه از محیط اطرافش بالاتر باشد، گرما از سامانه به محیط پیرامون منتقل می شود؛ یعنی سامانه گرما از دست می دهد و علامت گرما منفی است (Q<0). این مبادلۀ گرما تا وقتی انجام می شود که سامانه و محیط هم دما شوند. کاملاً واضح است که در این حالت دمای سامانه در اغلب مواد کاهش می یابد یعنی (Δθ<0).
نکته: وقتی دمای محیط از دمای سامانه بالاتر باشد، گرما از محیط پیرامون به سامانه منتقل می شود؛ یعنی سامانه گرما جذب می کند و علامت گرما مثبت است (Q>0). این مبادلۀ گرما تا زمانی انجام می شود که سامانه و محیط هم دما شوند. کاملاً واضح است که در این حالت دمای سامانه اغلب مواد افزایش می یابد؛ یعنی (Δθ>0).
نکتۀ مهم:
هر چند در اغلب فرآیندهای گرماده، دمای سامانه کاهش (Δθ<0) و در اغلب فرآیندهای گرماگیر دمای سامانه افرایش (Δθ>0) می یابد، اما فرآیندهای گرماده و گرماگیری هم وجود دارند که طی آنها، دما بدون تغییر است (Δθ=0). فرآیند سوخت و ساز مواد غذایی در بدن، از جملۀ این فرآیندها است.
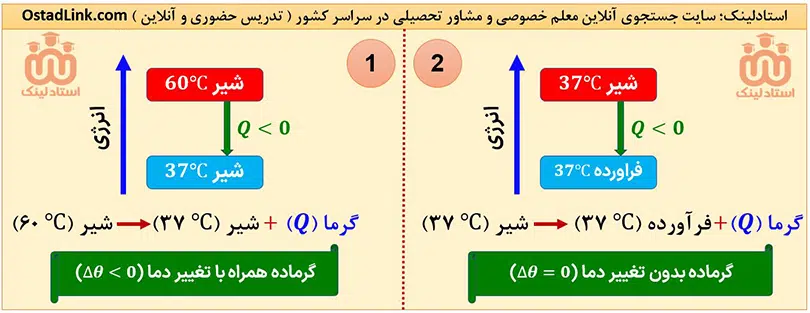
در هنگام خوردن بستنی، ابتدا قدری انرژی از بدن ما دریافت می شود (فرآیند گرماگیر) و سپس در هنگام هضم، انرژی بیشتری آزاذ می شود (فرآیند گرماده). پس در نهایت خوردن بستنی، واکنشی گرماده است و انرژی آزاد می شود.

جمع بندی فرایند گرماده و گرماگیر فیزیکی | تدریس خصوصی شیمی
هشدار: این جدول هم در درس شیمی و هم در درس فیزیک چندین مرتبه مورد سؤال قرار گرفته است.
نکته: تمام تغییر حالت ها ( تغییر فازهای ) زیر، فرآیند فیزیکی هستند نه شیمیایی!

با توجه به شکل بالا می توان نتیجه گرفت که:
- انرژی یک ماده در حالت گازی بیشتر از حالت مایع و آن هم بیشتر از حالت جامد است.
- برای یک مادۀ خالص، میزان تغییر انرژی در دو فرایند تبخیر و میعان، دو فرآیند انجماد و ذوب و همچنین دو فرآیند فرازش و چگالش با هم برابر است؛ به طور مثال مقدار انرژی مورد نیاز برای تبخیر مقدار معینی آب با مقدار انرژی آزاد شده از میعان همان مقدار آب، یکسان است.
- تفاوت انرژی یک ماده در حالت های مایع و گاز بیشتر از تفاوت انرژی آن ماده در حالت های جامد و مایع است. بنابراین می توان گفت انرژی مورد نیاز برای تبخیر مقدار معینی از یک ماده به حالت مایع، بیشتر از انرژی مورد نیاز برای ذوب همان مقدار ماده به حالت جامد است.

در پیوند با زندگی صفحۀ 62 و 63 کتاب درسی شیمی یازدهم چاپ 1401، با یک یخچال صحرایی آشنا می شویم که دستگاهی همانند یخچال است؛ با این تفاوت که بدون نیاز به انرژی الکتریکی، غذا را خنک و برای مدت طولانی تری نگه می دارد.
این دستگاه از دو ظرف سفالی ( ساخته شده از خاک رس ) تشکیل شده که فضای بین آنها با شن خیس پر شده است. درپوش این یخچال، پوششی نخی و مرطوب است که تهویه را به آسانی انجام می دهد. تبخیر آب از سطح بیرونی سفالی طبق رابطۀ زیر انجام می شود و باعث جذب گرما و کاهش دمای محفظۀ درون ظرف شده و به این ترتیب غذای درون آنرا خنک می کند.
H2O(l) + 44/1 kJ → H2O(g)
7- واکنش های گرماده و گرماگیر | آموزش شیمی یازدهم
در سال دهم خواندیم که هر واکنش شیمیایی ممکن است با تغییر رنگ، رسوب، آزاد شدن گاز و ایجاد نور و صدا همراه باشد، اما یک ویژگی بنیادی مشترک بین همۀ واکنش های شیمیایی، دادوستد گرما با محیط پیرامون است، به شاخه ای از علم شیمی که به بررسی کمّی و کیفی گرمای واکنش های شیمیایی، تغییر آن و تأثیری که بر حالت ماده دارد، می پردازد، ترموشیمی یا گرماشیمی می گویند.
واکنش ها نیز بر اساس این که در طی واکنش گرما آزاد شده یا گرما جذب شود به دو دستۀ زیر تقسیم می شود:
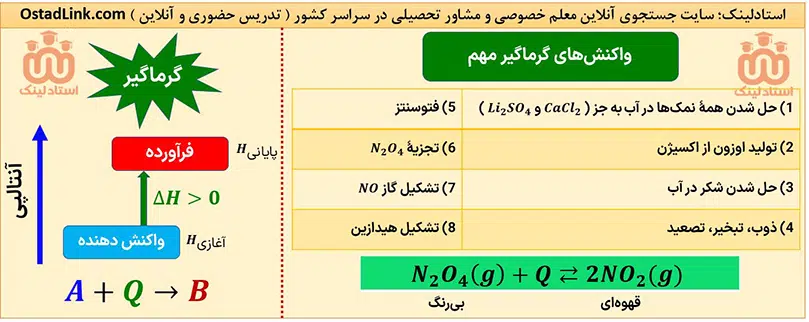
واکنش های گرماده مهم در کنکور شیمی
تمام واکنش های مهم گرماده در سه سال دبیرستان توسط سایت جستجوی معلم خصوصی و مشاور تحصیلی استادلینک برای شما عزیزان در جدول زیر گردآوری شده است.
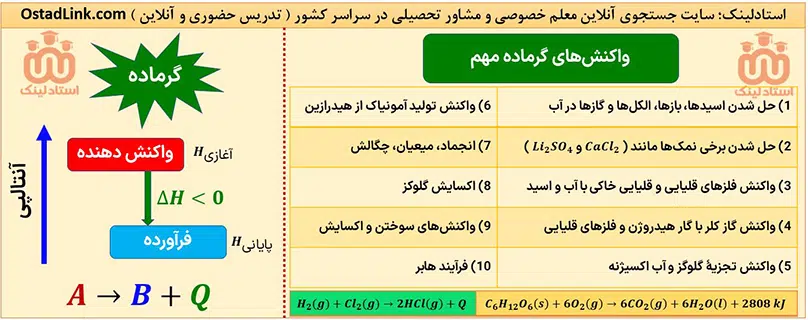
واکنش های گرماگیر مهم در کنکور شیمی
تمام واکنش های مهم گرماگیر در سه سال دبیرستان توسط سایت جستجوی معلم خصوصی و مشاور تحصیلی استادلینک برای شما عزیزان در جدول زیر گردآوری شده است.
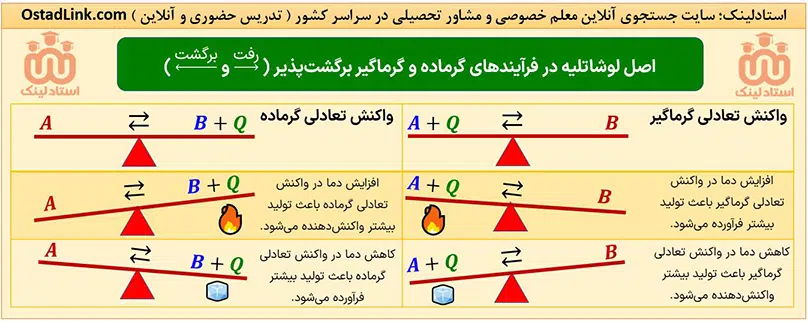
اصل لوشاتلیه در فرآیندهای گرماگیر و گرماده بازگشت پذیر
در سال دوازدهم خواهمی خواند که در واکنش های برگشت پذیر تعادلی، اگر تغییری بر سامانه اعمال شود، سامانه در جهتی جا به جا می شود که آن تغییر را تا حد امکان جبران کند.
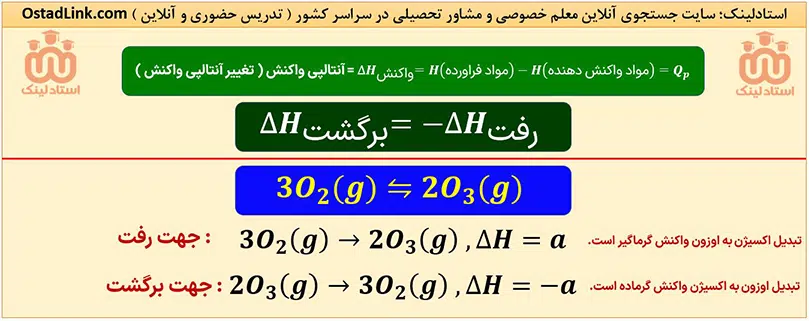
پس در تجزیۀ N2O4، با افزایش دما، رنگ محصول قهوه ای تر می شود و با کاهش دما، از شدت رنگ قهوه ای کم می شود.
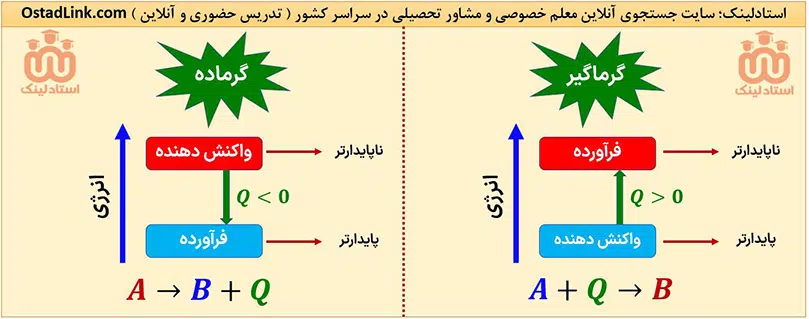
انرژی یک سامانه با پایداری آن رابطۀ معکوس دارد؛ به عبارت دیگر هر چه انرژی سامانه بیشتر باشد، آن سامانه ناپایدارتر است.
پس در واکنش های گرماده و گرماگیر این رابطه وجود دارد:

8- مبادلۀ گرما بر اثر انجام واکنش در دمای ثابت
اگر یک واکنش در دمای ثابت انجام شود، یعنی دمای مواد واکنش دهنده پیش از آغاز واکنش با دمای مواد فرآورده پس از پایان واکنش برابر باشند (Δθ=0)، باز هم میان سامانۀ واکنش و محیط پیرامون، گرما دادوستد خواهد شد. شیمی دان ها گرمای جذب یا آزاد شده در هر واکنش شیمیایی را به طور عمده وابسته به تفاوت میان انرژی پتانسیل مواد واکنش دهنده و فرآورده می دانند. انرژی پتانسیل یک نمونه ماده، انرژی نهفته در آن بوده و هم ارز با انرژی ناشی از نیروهای نگهدارندۀ ذره های سازندۀ آن است.
چند نکته مهم در مورد انرژی گرمایی (جنبشی) و انرژی پتانسیل
1- گرمای جذب یا آزاد شده در واکنشی که در دمای ثابت انجام می شود، ناشی از تفاوت انرژی گرمایی ( مجموع انرژی جنبشی ذره ها ) در مواد واکنش دهنده و فرآورده نیست؛ زیرا در دمای ثابت، تفاوت چشمگیری میان انرژی گرمایی آنها وجود ندارد.
2- با انجام واکنش شیمیایی، شیوۀ اتصال اتم ها به یکدیگر تغییر می کند و همین امر باعث تفاوت آشکار در انرژی پتانسیل وابسته به آنها شده و این تفاوت انرژی، در واکنش به شکل گرما ظاهر می شود.
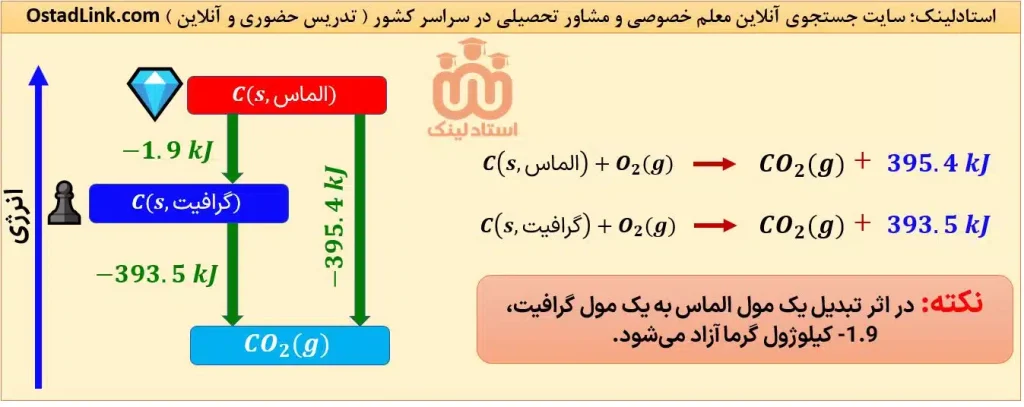
3- الماس و گرافیت دو دگرشکل (آلوتروپ) معروف کربن هستند. شیوۀ اتصال اتم های کربن به یکدیگر در این دو آلوتروپ متفاوت است؛ از این رو سطح انرژی این دو ماده با هم متفاوت هستند. توجه شود که الماس ناپایدارتر از گرافیت می باشد. همچنین سوختن الماس نسبت به گرافیت، انرژی بیشتری آزاد می کند.
9- عوامل مؤثر بر گرمای واکنش | تدریس خصوصی شیمی
گرمای واکنش به عوامل زیر بستگی دارد:
- نوع مواد واکنش دهنده و فرآورده
- دما و فشار
- مقدار واکنش دهنده ها
- حالت فیزیکی واکنش دهنده ها و فرآورده ها
نوع مواد واکنش دهنده و فراورده | تدریس شیمی یازدهم
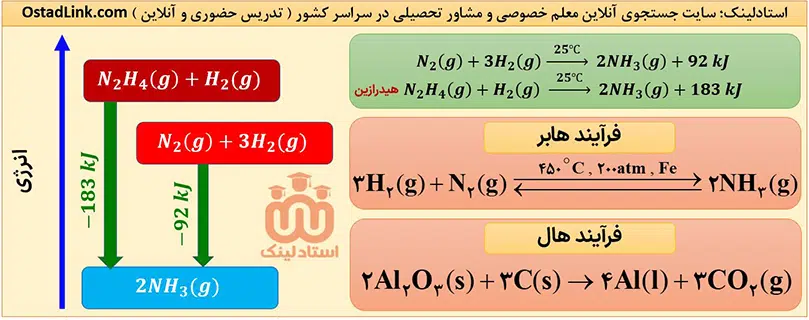
هر ماده در دما و فشار ثابت، انرژی معینی دارد، یعنی سطح انرژی مواد با هم متفاوت است؛ بنابراین گرمای واکنش ها با تغییر نوع مواد، تغییر می کند.
دما و فشار | کلاس خصوصی شیمی در اصفهان
سطح انرژی مواد به دما و فشار بستگی دارد؛ بنابراین برای تعیین گرمای یک واکنش، باید واکنش موردنظر در یک فشار معین و دمای ثابت انجام شود.
مقدار واکنش دهنده ها | آموزش خط به خط شیمی
هر چه مقدار مواد واکنش دهنده بیشتر باشد، مقدار گرمای مبادله شده نیز بیشتر خواهد بود.
حالت فیزیکی واکنش دهنده ها و فرآورده ها
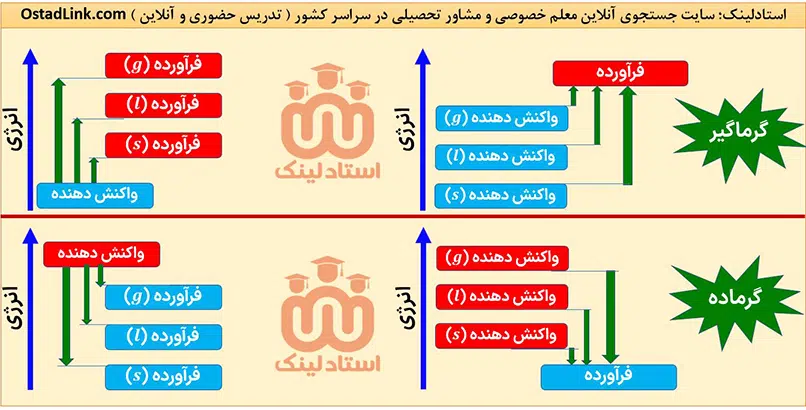
حالت فیزیکی مواد شرکت کننده در یک واکنش باید مشخص باشد؛ زیرا انرژی مواد در حالت های فیزیکی مختلف، متفاوت است. به طور کلی سطح انرژی یک ماده در حالت گازی بیشتر از حالت مایع و آن هم بیشتر از حالت جامد است.

10- آنتالپی ( محتوای انرژی )
همانطور که قبلاً خوانده ایم، هر نمونه ماده از تعداد بسیار زیادی ذره تشکیل شده است و هر یک از این ذره ها دارای انرژی جنبشی و انرژی پتانسیل هستند. انرژی جنبشی ذر ها، ناشی از حرکت و جنب و جوش آنها و انرژی پتانسیل، ناشی از بر هم کنش بین ذره های سازنده است.
توجه: یک نمونه ماده با مقدار آن در دما و فشار معین توصیف می شود؛ به طور مثال 200 گرم آب در دما و فشار اتاق را می توان یک نمونه ماده در نظر گرفت. حالا سامانه ای محتوی یک نمونه ماده را در نظر بگیرید. شیمی دان ها به انرژی کل چنین سامانه ای، محتوای انرژی یا آنتالپی می گویند.
هر سامانه یا هر نمونه ماده، در دما و فشار ثابت، آنتالپی معینی دارد. آنتالپی را را با نماد «H» نشان می دهند.آنتالپی یک ماده، یعنی محتوای انرژی آن، در دما و فشار ثابت به مقدار ماده و حالت فیزیکی آن بستگی دارد.
در واکنش های شیمیایی که در دما و فشار ثابت انجام می شوند، محتوای انرژی یا آنتالپی مواد تغییر می کند. این تغییر آنتالپی هنگان انجام واکنش به شکل مبادلۀ گرما با محیط پیرامون، ظاهر می شود. تغییر آنتالپی را با نماد «ΔH» نشان می دهند که هم ارز با گرمایی است که هنگام انجام واکنش، در فشار ثابت، با محیط پیرامون مبادله می شود.
گرمای واکنش در فشار ثابت، یعنی ΔH را با »Qp« نشان می دهند. البته خیلی از مواقع برای یک واکنش، به جای واژۀ تغییر آنتالپی واکنش، واژۀ آنتالپی واکنش به کار می رود.
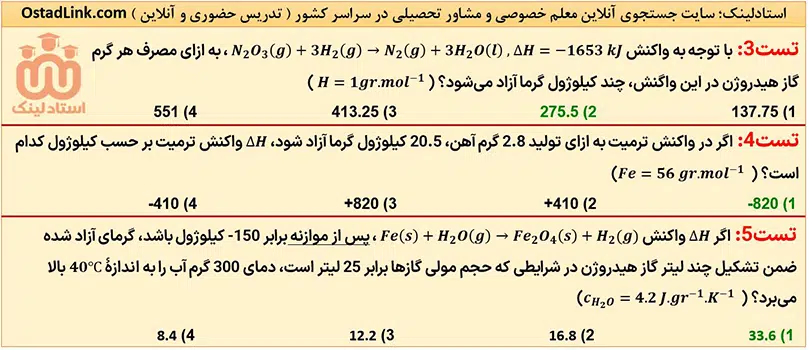
11- مسائل استوکیومتری آنتالپی به روش تناسب
ابتدا کلیۀ کسرهای پیش ساخته شیمی سایت استادلینک را از قسمت زیر دانلود کرده و سپس به کمک آنها مسائل داده شده را حل کنید.
تدریس خصوصی شیمی در اصفهان

برای موفقیت در امتحانات شیمی یازدهم، شیمی کنکور و امتحان نهایی شیمی، می توانید از کلاس های خصوصی شیمی سایت تدریس خصوصی استادلینک استفاده نمایید.
استادلینک با داشتن بهترین اساتید دروس مختلف در سراسر کشور و همچنین برگزاری کلاس های حضوری و آنلاین و ارائه بهترین خذمات با مناسب ترین هزینه، همواره در کنار شما دانش آموزان و داوطلبان کنکور سراسری است.
برای آگاهی از شرایط ثبت نام و جزئیات بیشتر به پشتیبانی سایت تدریس خصوصی استادلینک پیام دهید تا به شما مشاوره مناسب داده شود.
مقالات مرتبط فصل 2 آموزش شیمی یازدهم
با کلیک بر روی هر بخش زیر، می توانید به آموزش خط به حط شیمی ۲ بخش های مختلف فصل ۲ دسترسی داشته باشید.
| بخش صفر آموزش شیمی یازدهم – اهمیت شیمی در کنکور سراسری |
| بخش 1 آموزش شیمی یازدهم – ظرفیت گرمایی و گرمای ویژه |
| بخش 3 آموزش خط به خط شیمی یازدهم – آنتالپی پیوند و استوکیومتری در گرما شیمی |
| بخش چهارم آموزش خط به خط شیمی یازدهم |
| بخش پنجم آموزش خط به خط شیمی یازدهم |
| بخش ششم آموزش خط به خط شیمی یازدهم |























2 پاسخ