این بخش آموزش شیمی، شامل قسمت های زیر است:
20- استوکیومتری واکنش ها
21- تولید آمونیاک به روش هابر
20- استوکیومتری واکنش ها
| دانلود جزوه تمامی فرمول های شیمی |
استوکیومتری بخشی از شیمی است که به ارتباط کمّی میان مقدار مواد شرکت کننده در واکنش می پردازد. در محاسبات استوکیومتری، فقط و فقط؛ از معادلۀ موازنه شدۀ واکنش استفاده می کنیم. قبل از مطالعۀ این بخش ویدئوی موازنه واکنش های شیمیایی و ویدئوی استوکیومتری فصل اول را مشاهده نمایید.
توجه: به هر یک از ضرایب مواد شرکت کننده در یک معادلۀ موازنه شدۀ واکنش، ضریب استوکیومتری می گویند. همانطور که می دانید ضرایب استوکیومتری در یک معادلۀ موازنه شده، نسبت مول های مواد شرکت کننده را نشان می دهد، به طور مثال در واکنش زیر:
2SO2(g) + O2(g) —–> 2SO3(g)
یعنی، 2 مول SO2 و 1 مول O2 مصرف می شوند و 2 مول SO3 تولید می شود.
ویدئوی آموزش استوکیومتری واکنش ها
21- تولید آمونیاک به روش هابر
گاز نیتروژن فراوان ترین جزء سازندۀ هواکره بوده و در مقایسه با اکسیژن از نظر شیمیایی غیرفعال و واکنش ناپذیر است؛ به همین دلیل هرچند مخلوطی از گازهای اکسیژن و هیدروژن در حضور کاتالیزگر یا جرقه در یک واکنش سریع و شدید، منفجر شده و آب تولید می کند، اما در مخلوطی از گازهای نیتروژن و هیدروژن در حضور کاتالیزگر یا جرقه، هیچ واکنشی انجام نمی شود.

به همین دلیل گاز نیتروژن به جوّ بی اثر شهرت دارد. در محیط هایی که گاز اکسیژن عامل ایجاد تغییر شیمیایی است، به جای آن از گاز نیتروژن استفاده می شود.
برای پر کردن و تنظیم باد لاستیک خودروها بهتر است به جای هوا ( که مخلوطی از گازها است ) از گاز نیتروژن استفاده شود؛ زیرا با استفاده از نیتروژن برخلاف هوا، زنگ زدگی و خوردگی رینگ و تایر برطرف می شود.
هر چند گاز N2 واکنش پذیری ناچیزی دارد، اما در صنعت، مواد گوناگونی از جمله آمونیاک ( NH3 ) را زا آن تهیه می کنند. آقای هابر به دلیل تهیۀ آمونیاک از گازهای H2 و N2 برندۀ جایزۀ نوبل شیمی شد.

آقای هابر برای تهیۀ آمونیاک با دو چالش عمده روبرو شد:
- واکنش در دما و فشار اتاق انجام نمیشد. پس آقای هابر واکنش را در دماها و فشارهای گوناگون انجام داد تا بالاخره کشف کرد که این واکنش در دمای 450 درجۀ سانتی گراد و فشار 200 اتمسفر با حضور یک کاتالیزگر مانند آهن انجام می شود.
- واکنش تولید آمونیاک از گازهای نیتروژن و هیدروژن برگشت پذیر است و همۀ واکنش دهنده ها به فراورده ها تبدیل نمی شوند؛ یعنی در ظرف واکنش هر سه گاز هیدروژن، نیتروژن و آمونیاک وجود دارد؛ بنابراین چالش دوم آقای هابر این بود که چگونه می توان فراوردۀ واکنش (آمونیاک) را زا مخلوط واکنش جدا کرد؟
راه حل این بود که پس از انجام واکنش، دما را کمی پایین تر از نقطۀ جوش آمونیاک آورد تا فقط آمونیاک مایع شده و از مخلوط خارج کند.
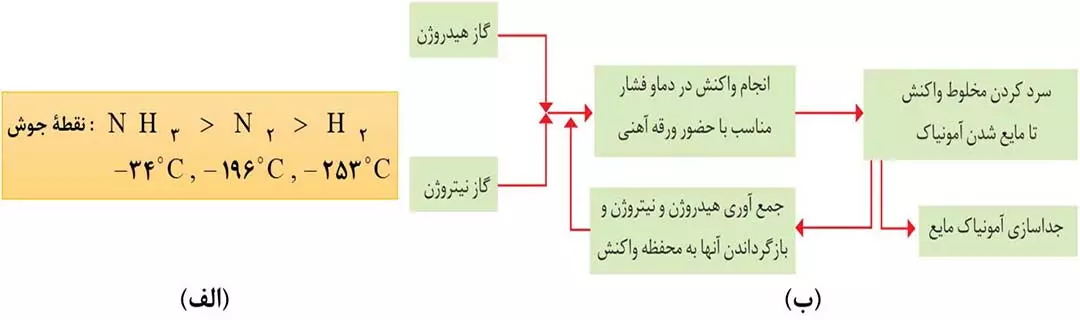
توجه: دما را به هیچ وجه نباید پایین تر از دمای جوش نیتروژن و هیدروژن آورد؛ چون در این شرایط این دو گاز نیز مایع شده و با آمونیاک مایع مخلوط می شوند.
توجه: در فصل سه خواهیم خواند که آمونیاک قطبی بوده و پیوند هیدروژنی دارد، پس دلیل اینکه نقطۀ جوش بالاتری دارد نیز همین امر است.
توجه: در فرایند هابر، N2 و H2 واکنش نداده را بازگردانی کرده و به ظرف اصلی واکنش بر می گردانند تا دوباره با هم واکنش دهند.
پایان بخش 6 فصل 2 آموزش خط به خط شیمی دهم به زبان ساده. کاری از سایت تدریس خصوصی استادلینک.
دانلود نمونه سوال فصل 2 شیمی دهم
برای دانلود نمونه سوال سری اول فصل 2 شیمی1، اینجا کلیک نمایید.
برای دانلود نمونه سوال سری دوم فصل 2 شیمی دهم، اینجا کلیک کنید.
برای دانلود نمونه سوال سری سوم فصل 2 شیمی دهم، اینجا کلیک کنید.
برای دانلود نمونه سوال سری چهارم فصل 2 شیمی دهم، اینجا کلیک کنید.
مقالات مرتبط فصل2 شیمی1
فصل2 – بخش صفر – اهمیت شیمی در کنکور سراسری
فصل2 – بخش اول – هواکره – تقطیر جزء به جزء هوای مایع
فصل2 – بخش دوم – اکسیژن – موازنۀ واکنش های شیمیایی
فصل2 – بخش سوم – ساختار لوویس – اثر گلخانه ای – اکسیدهای فلزی و نافلزی
فصل2 – بخش چهارم – شیمی سبز – توسعۀ پایدار – اوزون
فصل2- بخش پنجم – قانون آووگادرو – شرایط STP – قانون ترکیبی گازها




















یک پاسخ
سلام
خیلی ممنون از سایت استاد لینک
من کامل استوکیومتری شیمی دهم یاد گرفتم