این بخش شامل قسمت های زیر است:
5- اکسیژن، گازی واکنش پذیر در هواکره
6- واکنش های شیمیایی و قانون پایستگی جرم
7- موازنه کردن معادلۀ واکنش های شیمیایی
8- ترکیب اکسیژن با فلزها و نافلزها
5- اکسیژن، گازی واکنش پذیر در هواکره
| دانلود جزوه تمامی فرمول های شیمی |
حتماً نکات زیر را به خاطر بسپارید:
1) اکسیژن، پس از نیتروژن فراوان ترین گاز موجود در هواکره است که برای ادامۀ زندگی، لازم و ضروری است.
2) اکسیژن در آب کره، در ساختار مولکول های آب ( H2O )، در سنگ کره به صورت ترکیب با دیگر عنصرها و در هواکره به طور عمده به شکل مولکول های دو اتمی (O2) وجود دارد.
3) اکسیژن در ساختار همۀ مولکول های زیسنی مانند کربوهیدرات ها، چربی ها و پروتئین ها یافت می شود.
4) هرچند مقدار گاز اکسیژن در لایه های گوناگون هواکره با هم متفاوت است، ولی درصد حجمی اکسیژن در سه لایۀ اول ثابت و در حدود 20/95% است.
5) هرچه از سطح زمین بالاتر می رویم، هواکره رقیق تر شده و تعداد کل ذرات موجود در هر لیتر از هوا کاهش می یابد؛ بنابراین می توان نتیجه گرفت که با افزایش ارتفاع، فشار همۀ مولکول گازی از جمله گاز اکسیژن کم می شود.

توجه: فشار گاز اکسیژن در هر ارتفاعی از سطح زمین را می توان از رابطۀ شکل (1-ب) بدست آورد.

6) به علت کاهش مقدار اکسیژن هوا در ارتفاعات بالا،کوهنوردان هنگام صعود به قله های بلند از کپسول اگسیژن استفاده می کنند تا کمبود اکسیژن جبران شود.
7) اکسیژن ، گازی واکنش پذیر است و با اغلب عنصرها و مواد واکنش می دهد. بخش قابل توجهی از واکنش های شیمیایی که روزانه در اطرف ما رخ می دهد، به دلیل وجود گاز اکسیژن در هوا است؛ از جمله فاسد شدن مواد غذایی، پوسیدن چوب، فرسایش سنگ و خاک ، زنگ زدن وسایل آهنی، سوختن سوخت ها و هم چنین آزاد سازی انرژی شیمیایی ذخیره شده در مواد غذایی مانند چربی ها و قندها در سوخت و ساز باخته ای، به کمک اکسیژن انجام می شود.
انرژی + آب+ کربن دی اکسید <——– اکسیژن + چربی ها یا قند ها
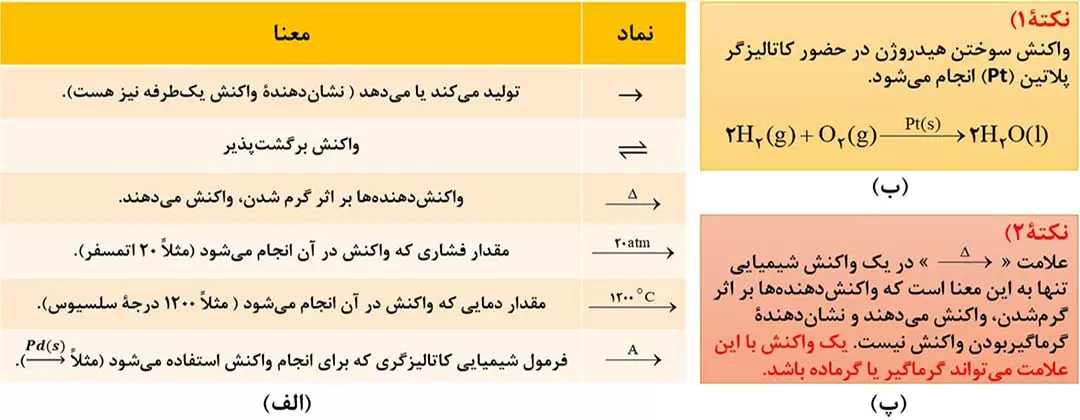
سوختن: یک واکنش شیمیایی است که درآن یک ماده با اکسیژن به سرعت واکنش می دهد و بخشی از انرژی شیمیایی ان به صورت گرما و نور آزاد می شود. به طور مثال سوختن زغال سنگ به صورت زیر است:
نور و گرما + کربن دی اکسید (CO2) + گوگرد دی اکسید (SO2) + بخار آب (H2O) <—— اکسیژن + زغال سنگ
توجه: جلوتر خواهیم خواند که بر اثر سوختن ناقص سوخت ها، کربن مونوکسید (CO) نیز تولید می شود. تازه! در کتاب درسی سال یازدهم،نیتروژن دی اکسید (NO2) نیز جزء فراورده های سوختن زغال سنگ آورده شده است؛ چون در ساختار زغال سنگ علاوه بر کربن، اغلب عنصرهای H,O,N و S هم وجود دارد.
بطور خلاصه، فراورده های حاصل از سوختن زغال سنگ می تواند H2O و SO2 و CO2 و CO و حتی NO2 هم باشد.
از سوختن کامل ترکیب های آلی به خصوص هیدروکربن ها (ترکیب هایی که از دو عنصر کربن و هیدروژن تشکیل شده اند، CO2 و H2O تولید می شود.
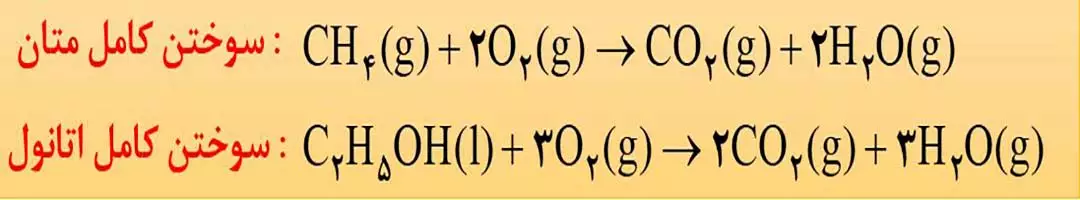
نکته) سوختن می تواند به دو صورت کامل و ناقص انجام شود. در واقع نوع فراورده ها در واکنش سوختن سوخت های فسیلی به مقدار اکسیژن در دسترس بستگی دارد. اگر اکسیژن کافی وجود داشته باشد، به این نوع سوختن، کامل می گویند؛ در غیر این صورت به آن سوختن ناقص گفته می شود.
در سوختن کامل هیدروکربن ها، گاز کربن دی اکسید و بخار آب تولید می شود، اما در سوختن ناقص آن ها، گاز کربن مونوکسید (CO) نیز به همراه گازهای
کربن دی اکسید و بخار آب تولید خواهد شد. در ضمن در سوختن کامل، رنگ شعله آبی و در سوختن ناقص، رنگ شعله زرد خواهد شد.
ویژگی های کربن مونوکسید (CO) عبارت اند از:
1) بسیار سمی، بی رنگ و بی بو است.
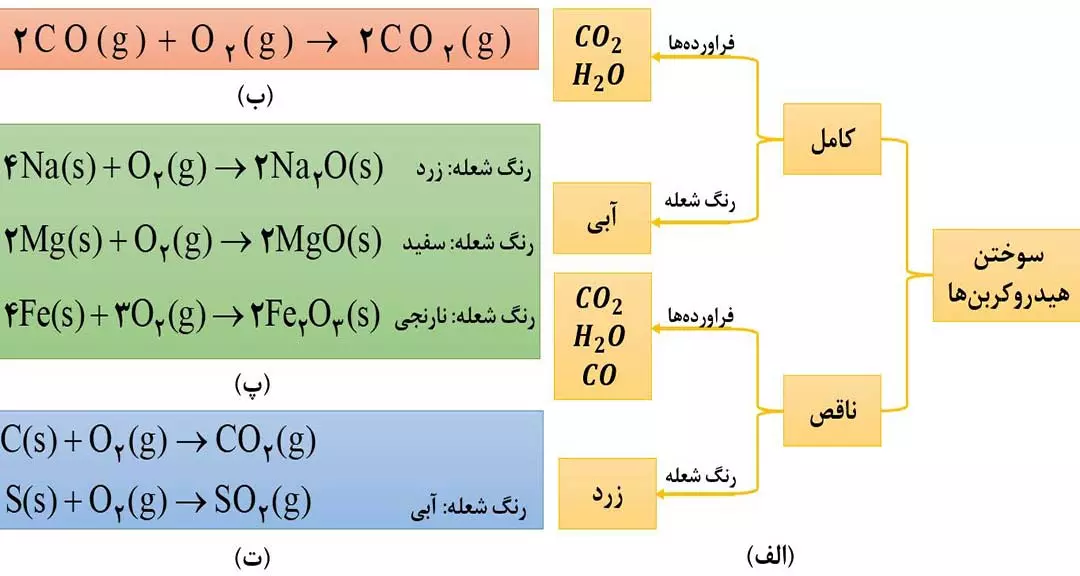
2) از گاز کربن دی اکسید ناپایدارتر است؛ به طوری که CO تولیدشده در سوختن ناقص، در حضور اکسیژن و در شرایط مناسب، دوباره میسوزد و به CO2 تبدیل می شود. ( شکل 4 ب )
3) استنشاق آن باعث مسمومیت می شود. بخاطر اینکه میل ترکیبی هموگلوبین خون با این گاز بسیار زیاد و بیش از ۲۰۰ برابر میل ترکیبی آن با اکسیژن است؛ بنابراین بعد از متصل شدن مولکول های این گاز به هموگلوبین، اکسیژن به بافت های بدن نمی رسد، باعث مسمومیت شده، سامانة عصبی، فلج و قدرت هرگونه اقدامی از فرد مسموم گرفته میشود و منجر به مرگ می شود.
4) این گاز سبک تر از هوا بوده (چگالی آن از هوا کمتر میباشد) و قابلیت انتشارش در محیط بسیار زیاد است؛ به همین دلیل به سرعت در تمامی نقاط اتاق منتشر می شود.
توجه: برخی از واکنش های سوختن به همراه رنگ شعله در شکل ( 4 – پ و 4 – ت ) آمده است که بهتر است به خاطر بسپارید.
6- واکنش های شیمیایی و قانون پایستگی جرم

• تغییر شیمیایی می تواند با تغییر رنگ، مزه، بو یا آزادسازی گاز، تشکیل رسوب و گاهی ایجاد نور و صدا همراه باشد.
• هر تغییر شیمیایی می تواند شامل یک یا چند واکنش شیمیایی باشد که هر یک از آنها را با یک معادله نشان می دهند.
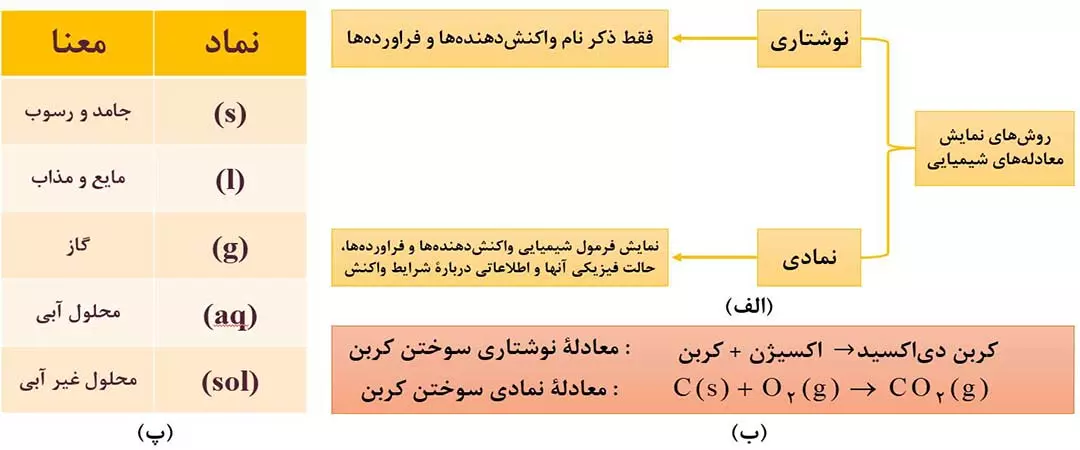
نمادهای به کار رفته برای نمایش خالت فیزیکی مواد معنای برخی عبارت ها یا نماد های مورد استفاده در معادله های شیمیایی به صورت زیر است:
• همه واکنش های شیمیایی از قانون پایستگی جرم یا ماده پیروی می کنند. مطابق این قانون، مجموع جرم واکنش دهنده ها با مجموع جرم فراورده ها برابر است یا به عبارت دیگر جرم کل مواد موجود در مخلوط واکنش ثابت می باشد.
یادآوری: در فصل اول خواندیم که در واکنش های هسته ای، مقداری از جرم مواد به انرژی تبدیل میشود؛ پس واکنش های هسته ای از قانون پایستگی جرم پیروی نمی کنند.

در واکنشی که قانون پایستگی جرم پیروی میکند ، می توان به نتایج زیر دست یافت:
1) تعداد اتم های هرعنصر در دو سمت معادله واکنش یکسان است؛ به طور مثال در واکنش سوختن هیدروژن، 2H2 + O2 —–> 2H2O ، هم در سمت راست و هم در سمت چپ، 4 اتم هیدروژن و 2 اتم اکسیژن وجود دارد.
2) مجموع تعداد اتم های موجود در واکنش دهنده ها با مجموع تعداد اتم های موجود در فراورده ها برابر است. به عبارت دیگر می توان گفت شمار کل اتم ها در یک واکنش شیمیایی ثابت می باشد؛ به طور مثال در واکنش سوختن هیدروژن، مجموع تعداد اتم های موجود در دو سمت واکنش برابر 6 است.
توجه: هر معادله ای که مجموع تعداد اتم های موجود در دو سمت آن برابر باشد، لزوماً از قانون پایستگی جرم پیروی نمی کند؛ یعنی لزومأ معادله موازنه نیست. به طور مثال در معادلۀ
N2 + H2 —–> NH3 ، مجموع تعداد اتم ها در دو سمت واکنش برابر با ۴ است، اما چون تعداد اتم های هر عنصردر دو سمت برابر نیست. این معادله از قانون پایستگی جرم پیروی نمی کند. در این موارد باید معادله واکنش را موازنه کرد (جلوتر با روش های موازنه کردن آشنا خواهیم شد)
تذکر: در یک واکنش شیمیایی لزوماً تعداد ملوکول ها و یا تعداد مول های مواد در دو طرف معادله برابر نیست؛ به طور مثال در واکنش سوختن هیدروژن
2H2 + O2 —–> 2H2O ، مجموع تعداد مولکول ها و مول های واکنش دهنده ها (3) با تعداد مولکول ها و مول های فراورده (2)، برابر نیست!
بدانید و آگاه باشید! که در واکنش های شیمیایی، مولكول ها، ترکیب و مواد از بین می روند و مولکول ها، ترکیب ها و مواد جدیدی به وجود می آیند. اونی که نه به وجود می آید و نه از بین میره، اتمه ، اتم!
7- موازنه واکنش های شیمیایی
خواندیم که در هر واکنش شیمیایی، باید تعداد اتم های هر عنصر در دو طرف معادلة واکنش یکسان باشد. در این صورت معادلة واکنش را معادلة موازنه شده می گویند برای موازنه کردن هر معادله نمادی باید به هر یک معادله نمادی باید به هر یک از واکنش دهنده ها و فراورده ها ضریبی نسبت داد تا تعداد اتم های هر عنصر در دو طرف معادله برابر شود. یکی از ساده ترین روش های موازنه، روش وارسی است. بریم ببینیم تو این روش باید چی كار کنیم:
گام اول: نوشتن معادلة موازنه نشدة واکنش و گذاشتن خط تیره پشت هر ماده!
گام دوم: شناسایی عنصر شروع کنندة موازنه، عنصر موردنظر باید شرایط زیر را داشته باشد.
- در هر سمت معادله، تنها در ساختار یک ماده وجود داشته باشد.
- اگر دو یا چند عنصر شرط اول را داشته باشند، از بین آنها عنصری شروع کنندة موازنه است که در هر دو سمت معادله به صورت ترکیب با سایر عناصر باشد یا به بیان دیگر به صورت یک مادة تک عنصری (مثل Fe، S، Cl2 و … ) نباشد.
- اگر دو یا چند عنصر، شرایط اول و دوم را داشتند، موازنه را از عنصری شروع می کنیم که در ترکیب پیچیده تری باشد؛ یعنی ترکیب دارای آن عنصر، تعداد و نوع اتم های بیشتری داشته باشد.
- اگر دو یا چند عنصر، سه شرط قبلی را داشته باشند، موازنه را با عنصری آغاز می کنیم که در پیچیده ترین ترکیب، زیروند بزرگتری داشته باشد.
گام سوم: موازنه کردن عنصر شروع کنندة موازنه در دو سمت معادله: پس از مشخص شدن عنصر شروع کنندة موازنه، به ترکیبی که عنصر شروع کننده در آن زیروند بزرگتری دارد، ضریب (1) میدهیم با مشخص شدن تعداد اتم های این عنصر در یک سمت معادله، به ترکیب دارای این عنصر در سمت دیگر معادله، ضریبی می دهیم تا تعداد این عنصر در دو سمت واکنش برابر شود.
گام چهارم: موازنه کردن بقیة عنصرها: پس از موازنة عنصر شروع کننده، موازنه را براساس عنصرهایی که تعداد اتم های آنها در یک سمت معادله مشخص شده و در سمت دیگر، تنها یک ضریب مربوط به آنها نامعلوم است، ادامه می دهیم.
توجه در هنگام موازنه کردن واکنش ها باید دو اصل زیر را رعایت کنیم:
1) هنگام موازنه کردن نباید زیروندهای موجود در فرمول شیمیایی واکنش دهنده ها و فراورده ها را تغییر داد.مثلاً نمی شود CH4 را به CH2 تبدیل کرد.
2) بر طبق قرارداد، ضرایب نهایی موجود در یک معادلة موازنه شده بایستی کوچک ترین عدد طبیعی ممکن باشد؛ یعنی ضریب کسری ممنوع! توجه کنید که اگر واکنش ها را به روشی که گفتیم، موازنه می کنید، در هر مرحله از موازنه که به ضریب کسری برخوردید! خیلی تند و سریع و انقلابی!! همة ضرایب معلوم شده را در عدد مخرج کسر موردنظر ضرب کنید تا ضریب کسری نیست و نابود شود!
آموزش ویدئویی موازنه واکنش های شیمیایی
8- ترکیب اکسیژن با فلزها و نافلزها
اغلب فلزها در طبیعت به شکل ترکیب ( عمدتاً به شکل اکسید ) وجود دارد. به طور مثال آلومنیوم و آهن به صورت ترکیب های بوکسیت ( Al2O3 به همراه ناخالصی ) و هماتیت ( Fe2O3 به همراه ناخالصی ) در طبیعت یافت می شوند.
به واکنش آرام مواد با اکسیژن که با تولید انرژی همراه است، اکسایش می گویند. به طور مثال زنگ زدن آهن نمونه ای از واکنش های اکسایش است که در آن آهن با اکسیژن در هوای مرطوب واکنش می دهد. 4Fe(s) + 3O2(g) —–> 2Fe2O3(s) که به Fe2O3 ، زنگ آهن می گویند.
زنگ آهن ، متخلخل است و باعث میشود بخار آب و اکسیژن به لایه های زیرین فلز آهن هم نفوذ کند و فرایند اکسایش آهن تا تبدیل همه ی فلز به زنگار ، ادامه پیدا کند. این ماده استحکام لازم ندارد و در اثر ضربه خورد میشود و فرو میریزد . به ترد و خرد شدن و فروریختن فلز ها بر اثر اکسایش ، خوردگی گفته می شود.
اگر دقت کرده باشید، واکنش فلز آهن با اکسیژن می تواند از نوع سوختن یا از نوع اکسایش باشد! بیایید به نگاهی به تفاوت ها و شباهت های این دو واکنش بندازیم!

از آنجایی که واکنش پذیری فلزها با هم فرق دارد، رفتار همۀ فلزها در برابر اکسیژن یکسان نیست. به طور مثال با این که فلز آلومینیوم نیز با اکسیژن هوا واکنش می دهد و به آلومینیوم اکسید تبدیل میشود، اما در برابر خوردگی مقاوم است و بر خلاف آهن ، لایه های درونی فلز اکسایش نمی یابد؛ به همین دلیل بیشتر وقت ها! در ساختمان سازی به جای در و پنجره های آهنی ار در و پنجره های آلومینیومی استفاده می شود.
دلیل این اتفاق این است که هر چند آلومینیوم واکنش پذیری بیشتری از آهن دارد و خیلی سریع اکسید میشود اما آلومینیوم اکسید( Al2O3 ) تولید شده ساختاری متراکم و پایدار دارد که محکم به سطح فلز می چسبد و از نفوذ اکسیژن به لایه های زیرین آلومینیوم جلوگیری می کند . این طوری است که آلومینیوم خورده نمی شود!
حواستون باشه! که هرچه واکنش پذیری یک فلز بیشتر باشد ، سرعت واکنش آن با اسید بیشتر شده، در نتیجه در یک بازه زمانی معین ، حباب های گازی بیشتری تولید می شود .
چند نکته:
1) سیم های انتقال برق با ولتاژ بالا (فشارقوی )، علاوه بر داشتن رسانایی الکتریکی زیاد، باید ضخیم و پوست کلفت! باشند و به عبارتی استحکام بالایی داشته باشند .
در برخی از کشور ها رشته درونی این سیم ها را از فولاد می سازند، زیرا فولاد که آلیاژی از آهن است ، ارزان تر است و استحکام بالایی دارد.
اما همه این سیم را نمی توان از فولاد ساخت؛ چون چگالی فولاد زیاد است و اگر همۀ سیم از فولاد ساخته شود، به دلیل جرم زیاد، سیم بین دو دکل برق به سمت پایین انحنا پیدا میکند و به مرور زمان باعث فرسایش سیم و خطوط برق می شود؛ و به همین دلیل روکش این سیم ها را از آلومینیوم می سازند؛ به چند دلیل :
الف) آلومینیوم فلزی سبک است.
ب) آلومینیوم اکسید ساختاری متراکم و پایدار دارد و از خوردگی رشته های درونی سیم جلوگیری میکند.
پ) رسانایی الکتریکی آلومینیوم بیشتر ا زآهن است.
2) چرا همۀ سیم را از آلومینیوم نمی سازند؟ چون آلومینیوم خیلی انعطاف پذیر است و سیم ها خیلی شل وول می شن! علاوه بر آن آلومينیوم فلزی گران قیمت است.
برای مشاهدۀ ویدئوی آموزش نامگذاری ترکیبات یونی و کوالاتسی، اینجا کلیک کنید.
پایان آموزش خط به خط شیمی دهم فصل2 بخش2 ( اکسیژن و موازنۀ واکنش های شیمیایی )، کاری از سایت تدریس خصوصی استادلینک.
مقالات مرتبط فصل2 شیمی1
فصل2 – بخش صفر – اهمیت شیمی در کنکور سراسری
فصل2 – بخش اول – هواکره – تقطیر جزء به جزء هوای مایع
فصل2 – بخش سوم – ساختار لوویس – اثر گلخانه ای – اکسیدهای فلزی و نافلزی
فصل2 – بخش چهارم – شیمی سبز – توسعۀ پایدار – اوزون
فصل2 – بخش پنجم – قانون آووگادرو – شرایط STP – قانون ترکیبی گازها






