این بخش شامل قسمت های زیر است:
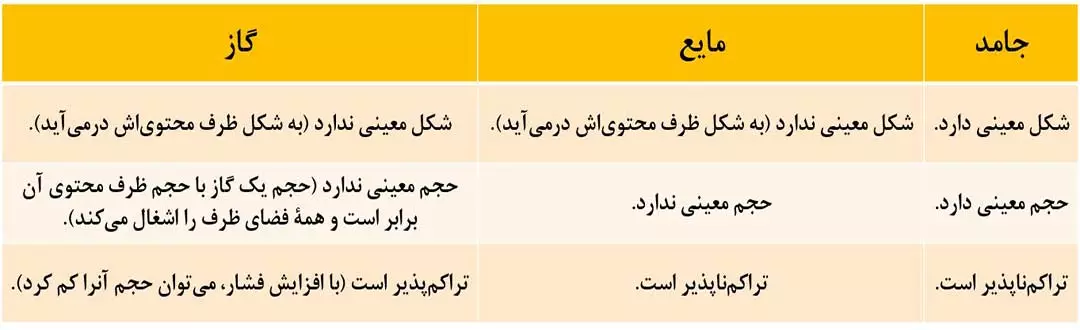
18- مقایسۀ خواص گازها با جامدات و مایعات
19- قانون ترکیبی گازها و نتایج آن ( P.V=n.R.T )
18- مقایسۀ خواص گازها با جامدات و مایعات
| دانلود جزوه تمامی فرمول های شیمی |
بدون مقدمه، به سراغ اصل مطلب می رویم:
19- قانون ترکیبی گازها و نتایج آن ( PV=nRT )
تعریف گاز ایده آل: به گازهایی که برهم کنشی روی هم ندارند و می توان آنها را به صورت نقطه ای در نظرگرفت، گاز ایده آل یا گاز کامل می گویند.
برای گازهای ایده آل می توان رابطۀ PV=nRT را در نظر گرفت که به بررسی آن می پردازیم:
- P: فشار گاز برحسب اتمسفر
- V: حجم گاز بر حسب لیتر
- n: تعداد مول گاز بر حسب مول
- R: ثابت عمومی گازها ( R=0.082 atm.L.mol-1.K-1 )
- T: دما بر حسب کلوین ( K=C+273 )
توجه: این فرمول را در فیزیک دهم می آموزید. توجه شود واحدهای گفته شده در درس فیزیک در SI بوده و با درس شیمی متفاوت است.
قانون آووگادرو و شرایط STP
تعریف شرایط STP: به دمای صفر درجۀ سانتی گراد ( 273 درجۀ کلوین ) و فشار یک اتمسفر، شرایط استاندارد دما و فشار (STP) می گویند.
شرایط متعارفی: به دمابی اتاق (حدوداً) 27 درجۀ سلسیوس ( 300 درجۀ کلوین ) و فشار یک اتمسفر، شرایط متعارفی می گویند.
قانون آووگادرو: در دما و فشار یکسان، حجمِ یک مول از گازهای مختلف با هم برابر است. اگر شرایط STP باشد، حجمِ یک مول از هر نوع گاز، حدوداً برابر 22/4 لیتر است.

ویدئوی آموزشی گازهای کامل
پایان بخش پنجم فصل 2 آموزش خط به خط شیمی دهم به زبان ساده. کاری از سایت تدریس خصوصی استادلینک
مقالات مرتبط فصل2 شیمی1
فصل2 – بخش صفر – اهمیت شیمی در کنکور سراسری
فصل2 – بخش اول – هواکره – تقطیر جزء به جزء هوای مایع
فصل2 – بخش دوم – اکسیژن – موازنۀ واکنش های شیمیایی
فصل2 – بخش سوم – ساختار لوویس – اثر گلخانه ای – اکسیدهای فلزی و نافلزی



















