این بخش شامل قسمت های زیر است:
1- هواکره و لایه های آن
2- هوا معجونی ارزشمند
3- تقطیر جزءبه جزء هوای مایع
4- آرگون و هلیم
1- هواکره و لایه های آن
| دانلود جزوه تمامی فرمول های شیمی |
به لايۀ هوايي كه كرۀ زمين را فرا گرفته اتمسفر يا هواكره گفته ميشود. اين اتمسفر، مخلوطي از گازهای گوناگون مي باشد كه تا فاصله 500 كيلومتري از سطح زمين امتداد يافته است .
چند نکته راجع به هواکره:
1- جاذبۀ زمين گازهاي موجود در اتمسفر را پيرامون خود نگه مي دارد و مانع خروج آنها ميشود.
2- انرژي گرمايي مولكول هاي گازي باعث ميشود تا آن ها همواره در حال جنبش باشند و در سرتاسر هواكره توزيع شوند.
3- اغلب گازها نامرئي هستند به طوري كه ما هوا را نميتوانيم ببينيم. حواستان باشد بعضي از گاز ها مانند ( نيتروژن دي اكسيد = NO2 ) که قهوه اي رنگ هست، قابل مشاهده هستند.
توجه: هر چند اغلب اجزاي سازندۀ هواكره بي رنگ هستند ولي اگر از فضا به زمين نگاه كنيم، هواكره را بصورت يك لايۀ فيروزه اي به دور زمين ميبينيم. به همین دلیل است که در کتاب درسی گفته شده: « لایۀ فیروزه ای پیرامون زمین، اتمسفر زمین یا همان هواکره است که اغلب، هوا نامیده می شود. »
4- ميان گازهاي سازنده هوا، واكنش هاي شيميايي مختلفي رخ ميدهد كه اغلب آن ها سودمند هستند ولي بعضي از آنها هم اينگونه نيستند چون فراورده هایی تولید می کنند که دلخواه ما نیست!
توجه: هواكره از چند لايه تشكيل شده است که در حد کتاب درسی، شما باید نام دو لایۀ اول و روند تغییرات دما در هر لایه را بلد باشید.
1- لايه اول (تروپوسفر): پايين ترين لايۀ هواكره است و در واقع همان بخشی از هواکره می باشد كه ما در آن زندگي ميكنيم. ارتفاع تقريبي اين لايه را ميتوان 12 كيلومتر در نظر گرفت. حدود 75 درصد جرم هواكره در لايه تروپوسفر قرار دارد.
توجه: تغييرات آب و هوايي در لايۀ تروپوسفر، یعنی از سطح زمين تا ارتفاع 10 الی 12 كيلومتري سطح آن، اتفاق مي افتد.
2- لایۀ دوم (استراتوسفر): اين لايه در ارتفاع حدود 12 تا 50 كيلومتري از سطح زمين قرار دارد. لايۀ اوزون نيز در اين لايه هست.
3- لایۀ سوم: از ارتفاع 50 تا 80 كيلومتري از سطح زمين را شامل ميشود.
روند تغییر دما در هواکره را می توان دلیلی بر لایه ای بودن آن دانست. به طور کلی در لایه های اول و سوم، با افزایش ارتفاع، دما کاهش می یابد، اما در لایۀ دوم، با افزایش ارتفاع، دما افزایش می یابد.
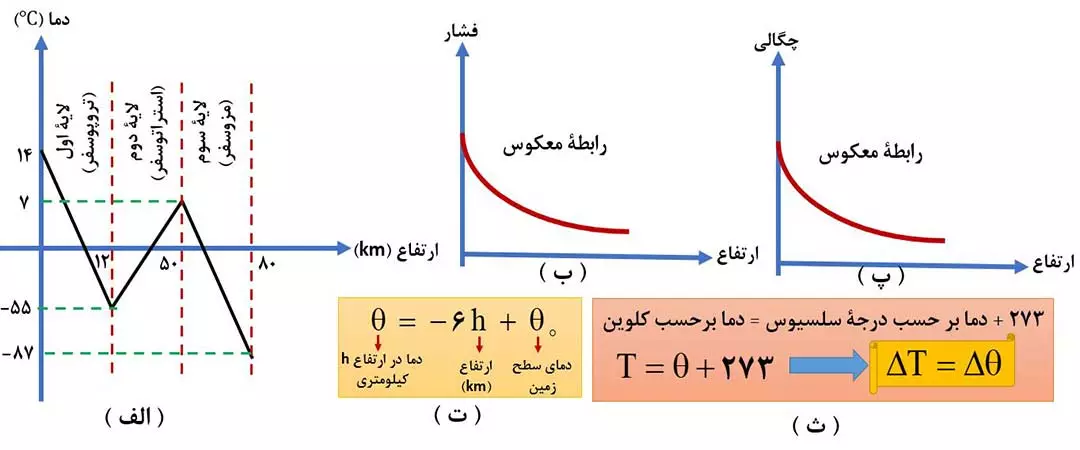
مطابق شکل 1-الف داریم:
لایۀ اول: از حدود 14 درجۀ سانتی گراد که دمای سطح زمین است تا دمای 55- درجۀ سانتی گراد است.
لایۀ دوم: از حدود 55- درجۀ سانتی گراد به دمای 7 درجۀ سانتی گراد می رود.
لایۀ سوم: از حدود 7 درجۀ سانتی گراد به دمای 87- درجۀ سانتی گراد می رود.
نکته: در لایۀ اول ( تروپوسفر )، با افزایش ارتفاع به ازای هر کیلومتر، دما در حدود 6 درجۀ سانتی گراد کم می شود. فرمول آن را در شکل 1-ت، مشاهده کنید.
نکته: یکی از مقیاس های دما، کلوین (K) است. در شکل 1-ث، رابطۀ تبدیل دما از کلوین به سانتی گراد ( برعکس ) را مشاهده می کنید.
نکتۀ مهم: دلتا به معنای تغییرات است. تغییرات دما در کلوین و سانتی گراد با هم برابر است. این نکته در فیزیک اثبات می شود و رابطۀ آنرا می تواند در شکل 1-ث قسمت زردرنگ مشاهده کنید.
توجه: هوا كره به دليل داشتن گازهاي گوناگون، فشار دارد. با افزايش دما در هواكره ( در همۀ لایه ها ) هواکره رقيق تر ميشود؛ از اين رو با فاصله گرفتن از زمين چگالي و فشار هوا كاهش مي يابد.
توجه: میزان کاهش فشار در ارتفاع های پایین تر، بیشتر است.

اجزای سازندۀ لایه های هواکره
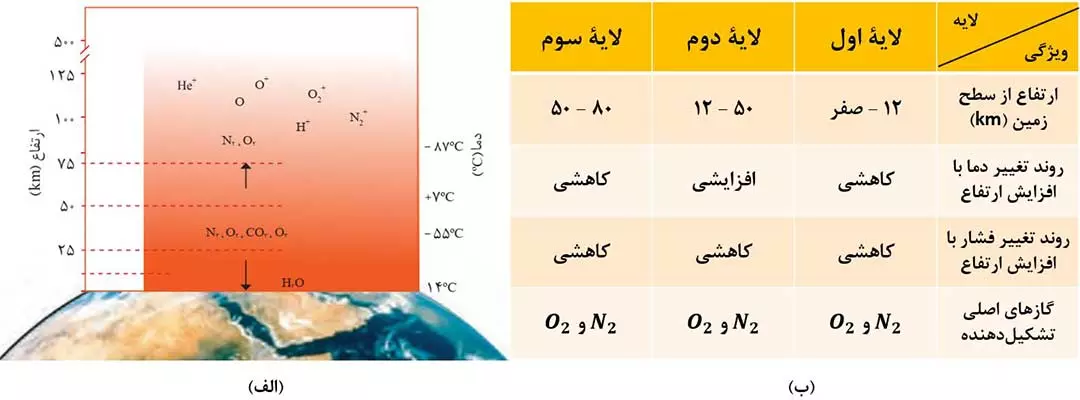
همانطور که در شکل 3-الف مشاهده می کنید:
1) گازهای N2 , O2 , CO2 و O3 در سه لایۀ اول هواکره، یعنی تا ارتفاع 80km، وجود دارند.
2) بخار آب ( H2O )، به طور عمده در لایۀ اول (تروپوسفر) یافت میشود.
3) در لایه های بالایی هواکره ( ارتفاع بیش از 80km )، علاوه بر گازهای N2 و O2، اتم اکسیژن (O) و یک تعداد یون مانند +N2+, O2+, O+ ، He و +H نیز وجود دارد. دلیل آن، برخورد پرتوهای پرانرژی خورشید به مولکولها و اتم ها و تبدیل آنها یون های مثبت است.
2- هوا معجونی ارزشمند
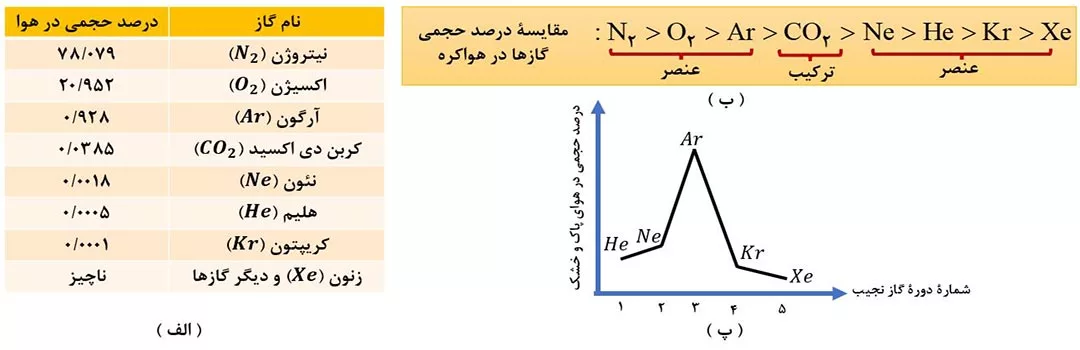
درصد حجمی گازهای تشکیل دهندۀ هوای پاک و خشک در تروپوسفر به صورت شکل (4-الف) است.
نکات شکل (4-الف):
1) بخش عمدۀ هواکره را به ترتیب گازهای نیتروژن و اکسیژن تشکیل می دهد. گاز آرگون در میان اجزای هواکره رتبۀ سوم را دارد. در صنعت این سه گاز را از تقطیر جزء به جزء هوای مایع تهیه می کنند.
2) چهارمین گاز فراوان هواکره، کربن دی اکسید ( CO2 ) بوده که یک ترکیب است.
توجه: تیتروژن، اکسیژن و کربن دی اکسید از جمله گازهای هواکره هستند که در زندگی روزانه، نقش حیاتی دارند؛ به طور مثال، گیاهان با بهره گیری از نور خورشید و مصرف کربن دی اکسید هواکره، اکسیژن مورد نیاز جانداران را تولید می کنند. جانداران ذره بینی هم، گاز نیتروژن هواکره را برای مصرف گیاهان در خاک تثبیت می کنند.
3) مقایسۀ درصد حجمی 8 گاز مهم هواکره، در شکل (4-ب) آمده است. به دو نکتۀ زیر نیز توجه کنید.
الف) فراوان ترین ترکیب هواکره، CO2 است.
ب) فراوان ترین گاز نجیب هواکره، Ar است.
4) از آنجایی که جدول شکل (4-الف) مربوط به هوای پاک و خشک است، خبری از H2O در این جدول نیست. به طور کلی رطوبت هوا متغیر بوده و میانگین بخار آب در هوا، حدود یک درصد است. البته همین مقدار هم از جایی به جایدیگر و در روز و ساعت های مختلف هم، متفاوت است.
5) بررسی دانشمندان در مورد هوای به دام افتاده در بلورهای یخ دریخچال های قطبی و نیز سنگ های آتشفشانی نشان می دهد که از 200 میلیون سال پیش تاکنون، نسبت گازهای سازندۀ هواکره به تقریب ثابت مانده است.
6) از فراوان ترین گاز هواکره، یعنی نیتروژن، در بسته بندی مواد غذایی، پرکردن تایر خودروها، انجماد مواد غذایی در صنعت سرماسازی و نگهداری از نمونه های بیولوژیکی استفاده می شود.
3- تقطیر جزء به جزء هوای مایع
تقطیر جزء به جزء یک فرایند فیزیکی برای جداسازی موادی با نقطۀ جوش نزدیک به هم است.
مراحل جداسازی هوا به روش تقطیر جزء به جزء به این صورت است:
1) در ابتدا، هوا را از صافی هایی عبور می دهند تا گردوغبار آن گرفته شود.
2) با استفاده از فشار، دمای هوا را پیوسته کاهش می دهند. ابتدا با کاهش دما تا صفر درجه، رطوبت هوا (H2O) هوا به صورت یخ جدا می شود، سپس در دمای 78- درجه، گاز کربن دی اکسید به حالت جامد درآمده و یخ خشک را از مخلوط گازی جدا می کنند.
3) مخلوط را تا دمای 200- درجه سرد می کنند. به این ترتیب، مخلوط بسیار سردی از چند مایع پدید می آید که به آن هوای مایع می گویند.
توجه: هنگام مایع کردن چند گاز با کاهش دما، ابتدا گازی مایع می شود که نقطۀ جوش بالاتری دارد.
4) با عبور هوای مایع از یک ستون ستون تقطیر و افزایش دما، هر یک از مایعات موجود در این مخلوط، در نقطۀ جوش خود تبخیر شده و می توان بخارهای آنها را به طور کامل جمع آوری کرد.
توجه: هر چه نقطۀ جوش ماده ای پایین باشد، زودتر به جوش آمده و زودتر از این مخلوط مایع جدا می شود. پس مراقب باشید، اگر مقایسۀ نقطۀ جوش دو مادۀ A و B به صورت A>B باشد، هنگام مایع کردن این دو گاز، ابتدا A که نقطۀ جوش بالاتری دارد، مایع می شود ولی اگر بخواهیم A و B مایع را به گاز تبدیل کنیم، ابتدا B که نقطۀ جوش پایین تری دارد، به گاز تبدیل می شود.

در شکل (5-پ) دقت شود که در دمای 200- درجه، که بالاتر از دمای جوش هلیم یعنی 269- درجه است، هلیم به صورت گاز وجود دارد.
توجه: تهیۀ اکسیژن 100% خالص به کمک تقطیر جزء به جزء هوای مایع دشوار است؛ زیرا نقطۀ جوش Ar و O2 بسیار نزدیک هم است.
4- آرگون و هلیم
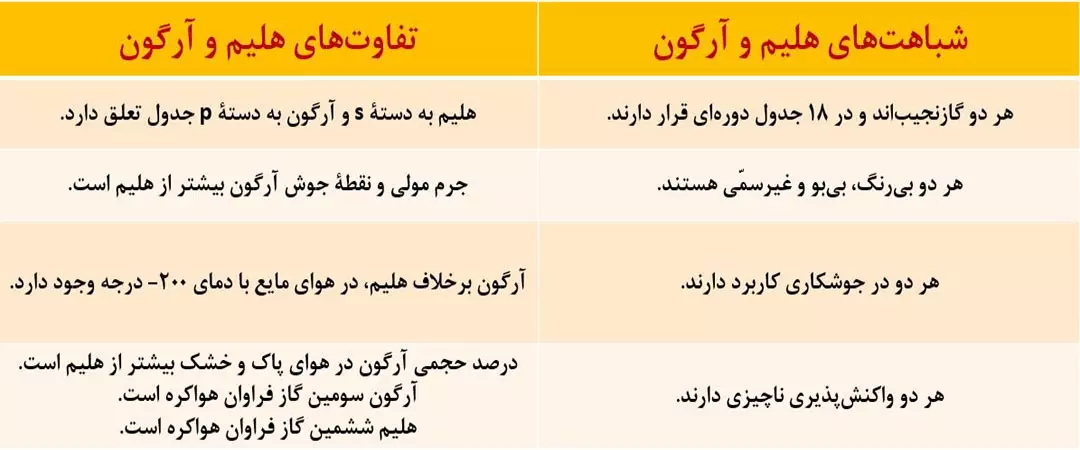
مقدار گازهای نجیب مانند هلیم، نئون، آرگون، کریپتون و زنون در هواکره بسیار کم است. ازاین رو به گازهای کمیاب نیز معروف هستند.
الف) آرگون:
* گازی بی رنگ، بی بو و غیرسمی است.
* در بین گازهای سازندۀ هواکره، درصد حجمی گاز آرگون پس از دو گاز نیتروژن و اکسیژن، رتبۀ سوم را دارد پس آرگون فراوان ترین گازنجیب هواکره است.
* واژۀ آرگون به معنای تنبل است، زیرا این گاز واکنش پذیری ناچیزی دارد.
* آرگون به عنوان محیط بی اثر در جوشکاری، برش فلزها و همچنین در ساخت لامپ های رشته ای به کار می رود.
ب) هلیم:
* سبک ترین گاز نجیب است.
* گازی بی رنگ، بی بو و بی مزه است.
* از هلیم در پرکردن بالون های هواشناسی، تفریحی و تبلیغاتی، جوشکاری، پرکردن کپسول غواصی و مهم تر از همه، خشک کردن قطعات الکترونیکی در دستگاه های تصویربرداری MRI استفاده می شود.
* هلیم در کرۀ زمین به مقدار خیلی کمی یافت می شود؛ به طوری که مقداری ناچیزی از آن در هوا و مقدار بیشتری در لایه های زیرین پوستۀ زمین وجود دارد؛ بنابراین، منابع زمینی آن، از هواکره سرشارتر و برای تولید هلیم در مقیاس صنعتی مناسب تر است.
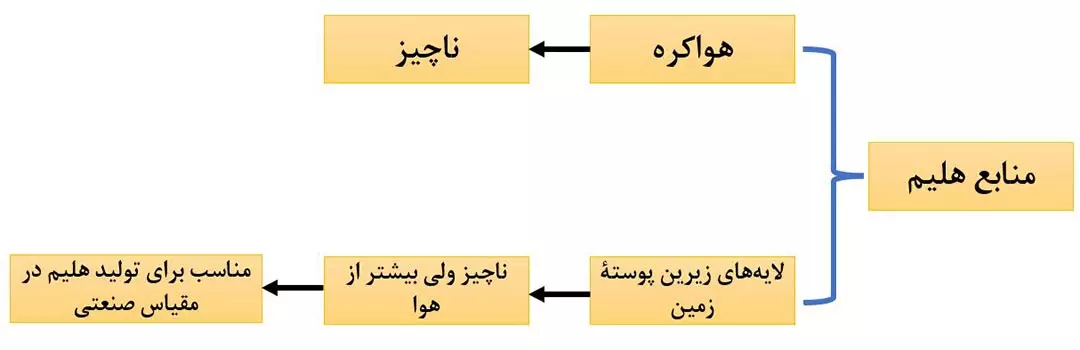
* هلیم از واکنش های هسته ای در اعماق زمین تولید می شود. این گاز پس از نفوذ به لایه های زمین، وارد میدان های گازی می شود.
* حدود 7% حجمی از مخلوط گاز طبیعی را هلیم تشکیل می دهد. البته مقدار آن در میدان های گازی گوناگون، متفاوت است.
* هر چند هلیم را می توان هم از هوای مایع و هم از تقطیر جزء به جزء گاز طبیعی بدست آورد، ولی از آنجایی که مقدار هلیم در گاز طبیعی بیشتر است، تهیۀ هلیم از تقطیر جزء به جزء گاز طبیعی، مقرون به صرفه تر است.
* جداسازی هلیم از گاز طبیعی، نیاز به فناوری پیشرفته ای دارد که هنوز ایران به آن دست نیافته و مجبور به واردات آن هستیم.
* با سوزاندن گاز طبیعی، هلیم موجود در آن به همراه سایر فراورده های سوختن، بدون مصرف وارد هواکره می شود.
مقایسۀ هلیم و آرگون
پایان بخش اول فصل دوم آموزش شیمی دهم به زبان ساده، کاری از سایت تدریس خصوصی استادلینک
مقالات مرتبط فصل2 شیمی1
فصل2 – بخش صفر – اهمیت شیمی در کنکور سراسری
فصل2 – بخش دوم – اکسیژن – موازنۀ واکنش های شیمیایی
فصل2 – بخش سوم – ساختار لوویس – اثر گلخانه ای – اکسیدهای فلزی و نافلزی
فصل2 – بخش چهارم – شیمی سبز – توسعۀ پایدار – اوزون
فصل2 – بخش پنجم – قانون آووگادرو – شرایط STP – قانون ترکیبی گازها



















