بخش 3 فصل ۲ آموزش خط به خط شیمی یازدهم شامل موارد زیر می باشد:
- آنتالپی پیوند و میانگین آن
- تعیین آنتالپی واکنش ها با اسفاده از آنتالپی پیوند
- گروه های عاملی
- ارزش سوختی مواد غذایی
- آنتالپی سوختن و مسائل آن
12- آنتالپی پیوند و میانگین آن | آموزش شیمی یازدهم
| دانلود جزوه تمامی فرمول های شیمی |
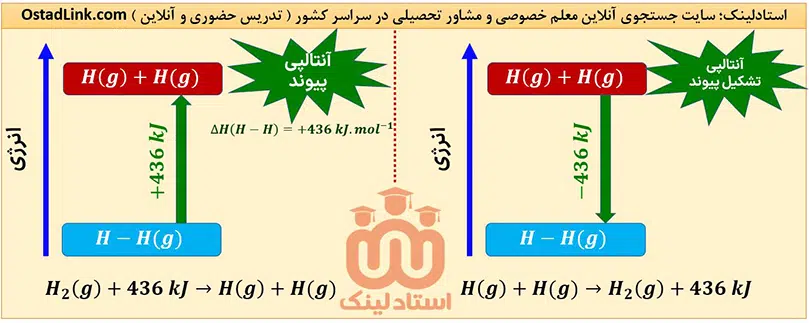
به مقدار انرژی لازم برای شکستن یک مول پیوند اشتراکی ( کووالانسی ) در حالت گازی و تبدیل آن به اتم های گازی مجزا، آنتالپی پیوند می گویند.
توجه: مقدار آنتالپی پیوند همواره عددی مثبت بوده و یکای آن کیلوژول بر مول (kJ.mol-1) است.
مثال: برای شکستن یک مول پیوند «H-H» در H2(g) و تبدیل آن به دو اتم H(g)، مقدار 436 کیلوژول انرژی لازم است، بنابراین آنتالپی پیوند «H–H» برابر 436kJ.mol-1 + است.
توجه: به ΔH واکنشی که برعکس واکنش مربوط به آنتالپی پیوند باشد، آنتالپی تشکیل پیوند می گویند و مقدار آن همواره عددی منفی است.
هشدار: مواد سمت چپ و راست معادلۀ مربوط به آنتالپی پیوند ( و همچنین آنتالپی تشکیل پیوند ) همگی باید گازی شکل باشند؛ به طور مثال ΔH واکنش Br2(l) —> 2Br(l)، آنتالپی پیوند Br–Br(g) را نشان نمی دهد.
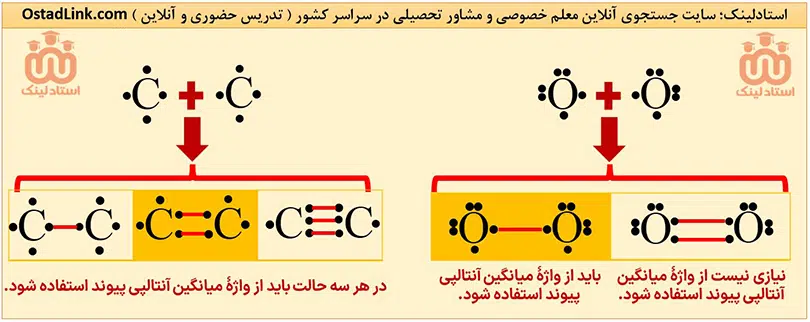
برای مولکول هایی ماندد NH3 , H2O و CH4 که در آنها، اتم مرکزی به چند اتم کناری یکسان با پیوندهای اشتراکی متصل است، به کار بردن «میانگین آنتالپی پیوند» مناسب تر است. به عبارت دیگر برای پیوندهایی که حداقل 2 یا تعداد بیشتری از آنها می تواند در یک مولکول وجود داشته باشد، گفتن نام میانگین آنتالپی مناسب تر است.

توجه: مهم ترین پیوندهایی که برای آنها از واژۀ «میانگین پیوند« استفاده می شود، عبارت اند از:
C≡C , C=C , C-C , C=O , C-O , O-H , N-H , C-H
توجه: در مورد پیوندهایی که در مولکول دو اتمی وجود دارد مانند:
- H-H در H2
- N≡N در N2
- O=O در O2
- Cl-Cl در Cl2
- Br-Br در Br2
- H-F در HF
- H-Cl در HCl
- و …
چون فقط همین یک نوع پیوند اشتراکی وجود دارد، دیگر نیازی به استفاده از واژۀ میانگین آنتالپی پیوند نیست.
راهکار: برای تعیین اینکه چه پیوندی بهتر است از میانگین آنتالپی بیان شود ابتدا آرایش الکترون-نقطه ای ( ساختار لوویس ) اتم های درگیر در پیوند را بکشیم و آنها را با توجه به نوع پیوند به هم متصل کنیم. اگر برای اتم ها الکترون جفت نشده ای باقی ماند، بهتر است از میانگین آنتالپی پیوند استفاده شود.
مقایسه مقدار آنتالپی پیوندها | تدریس کنکوری شیمی
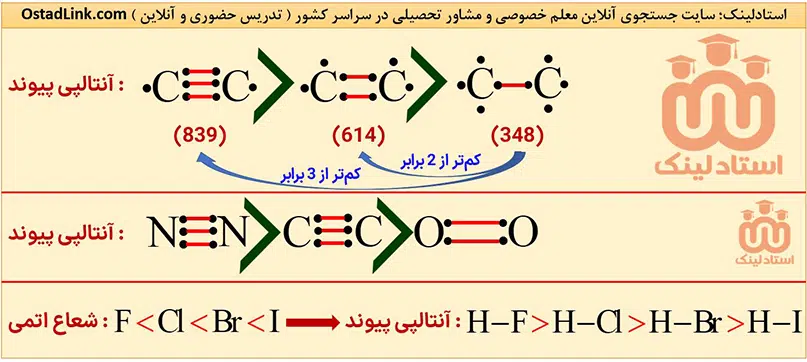
برای مقایسه مقدار آنتالپی پیوندها، فعلاً دو عامل زیر را بدانید:
- تعداد پیوند بین دو اتم ( مرتبۀ پیوند ): هر چه تعداد پیوند بین دو اتم بیشتر باشد، آنتالپی پیوند بیشتر خواهد بود. به عبارت دیگر آنتالپی پیوند سه گانه بیشتر از دوگانه و آنتالپی پیوند دوگانه بیشتر از یگانه است.
- شعاع اتم های تشکیل دهندۀ پیوند: به طور کلی هر چه شعاع اتم های تشکیل دهندۀ پیوند کوچک تر باشد، انرژی لازم برای شکستن آن بیشتر و در نتیجه آنتالپی پیوند بیشتر می شود.
ΔH واکنش های گازی را که در آنها همۀ مواد شرکت کننده گازی شکل باشند، می توان به کمک آنتالپی های پیوند محاسبه کرد. توجه شود که برای واکنش های گازی که در آنها فقط یک یا چند پیوند شکسته می شود، ΔH واکنش برابر با مجموع آنتالپی پیوندهای شکسته شده است.
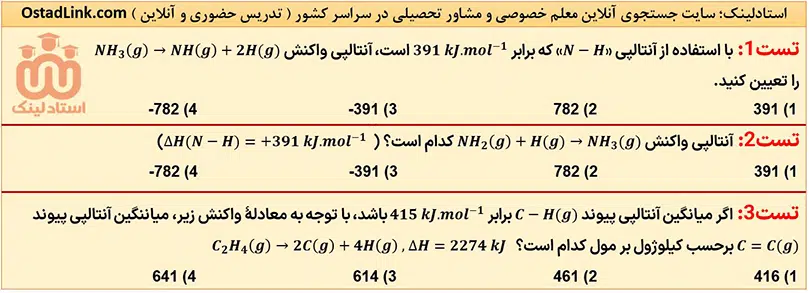
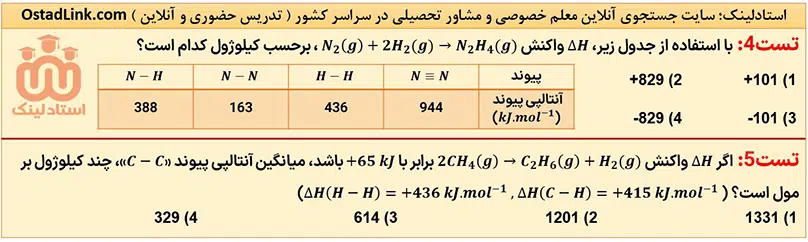
13- تعیین آنتالپی واکنش ها با استفاده از آنتالپی پیوند
استفاده از آنتالپی های پیوند، یک روش محاسباتی برای تعیین ΔH برخی واکنش ها است. فرض کنید واکنش ها در یک فرآیند دو مرحله ای انجام می شوند؛ در مرحلۀ اول، همۀ پیوندهای موجود در واکنش دهنده هاشکسته شده و واکنش دهنده ها به اتم های جدا از هم تبدیل می شوند. در مرحلۀ بعدی این اتم ها دوباره با هم پیوند تشکیل داده و فرآورده را به وجود می آورند.
ΔH مرحلۀ اول در واقع همان مجموع آنتالپی پیوندهای موجود در واکنش دهنده ها است؛ زیرا در آن واکنش دهنده ها به اتم های جدا از هم تبدیل می شوند، اما ΔH مرحلۀ دوم، ΔH تشکیل پیوندها بوده و برابر با منفی آنتالپی پیندهای موجود در فراورده ها است.
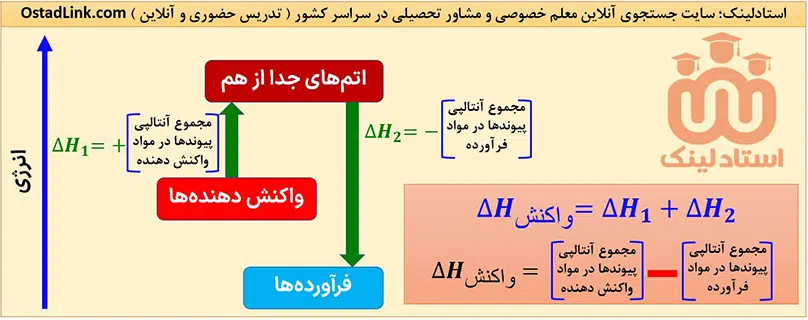
نکتۀ مهم: با توجه به تعریف آنتالپی پیوند، به کار بردن آنتالپی های پیوند برای تعیین ΔH واکنش هایی مناسب است که همۀ مواد شرکت کننده در آن به حالت گاز باشند. در چنین واکنش هایی هر چه مولکول های مواد شرکت کننده ساده تر باشند، آنتالپی واکنش محاسبه شده با داده های تجربی همخوانی بیشتری خواهد داشت، در حالی که به کار بردن میانگین پیوندها برای تعیین ΔH واکنش های گازی با مولکول های پیچیده تر، اغلب در مقایسه با داده های تجربی، تفاوت آشکاری را نشان می دهد.
14- گروه عاملی | آموزش خط به خط شیمی یازدهم
بررسی مواد آلی موجود در ادویه ها، داروها و … نشان می دهد که وجود آرایش ویژه ای از اتم ها به نام گروه عاملی نقش تعیین کننده ای در خواص آنها دارد.
تعریف گروه عاملی: به آرایش منظمی از اتم ها که به مولکول آلی دارای آن، خواص فیزیکی و شیمیایی منحصر به فردی می دهد، گروه عاملی می گویند.
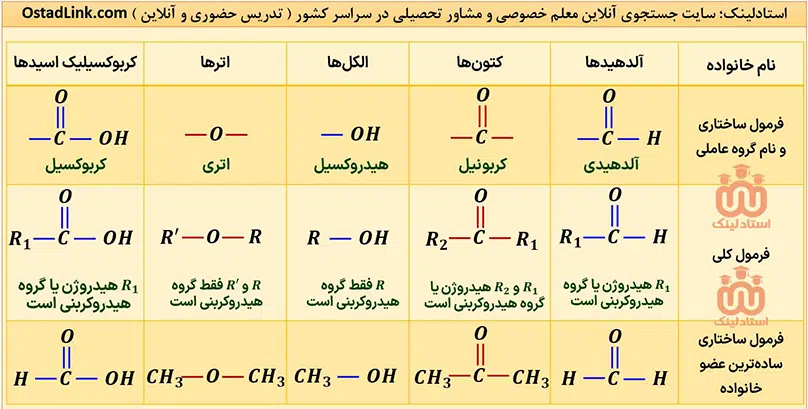
گروه های عاملی شیمی یازدهم
کلیۀ گروه های عاملی که در شیمی یازدهم فصل 2 می خوانید در عکس زیر آمده است:
1- آلدهیدها و کتون ها | معلم خصوصی شیمی در اصفهان
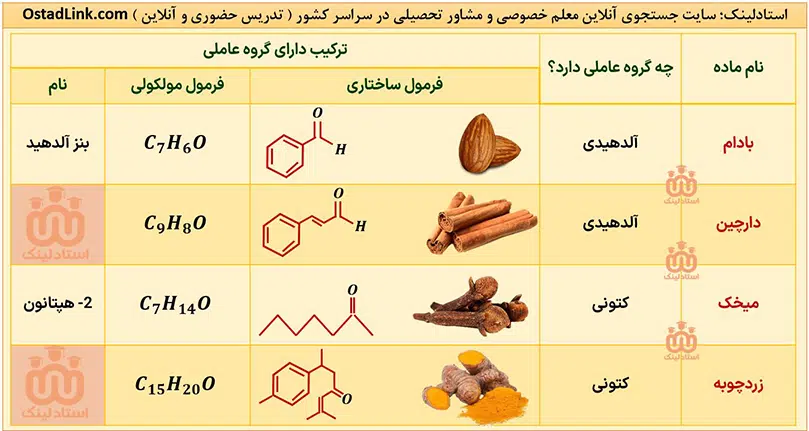
آلدهیدها و کتون ها دو دستۀ مهم از ترکیب های آلی هستند که هر دو در ساختار خود دارای گروه کربونیل (-(C=O)-) هستند. مهم ترین تفاوت میان آلدهیدها و کتون ها، وجود اتم هیدروژن متصل به گروه کربونیل در آلدهیدها است.
در کتون ها R1 و R2 گروه هیدروکربنی هستند. واضح است که اگر در کتون ها به جای R1 و R2 یا هر دو، هیدروژن قرار گیرد، به آلدهید تبدیل می شوند و دیگر شباهتی به کتون ها ندارند.
توجه: با توجه به توضیحات بالا، در کتون ها برخلاف آلدهیدها، گروه کربونیل نمی تواند در ابتدای زنجیر کربنی قرار بگیرد.
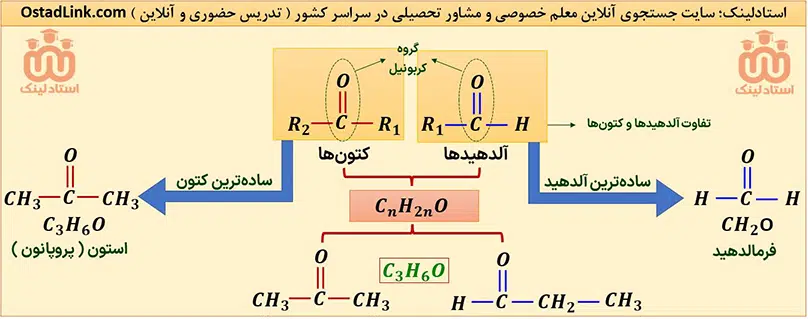
شیمی دان ها به موادی که فرمول مولکولی یکسان اما ساختار متفاوتی دارند، ایزومر ( هم پار ) می گویند.
آلدهیدها و کتون ها که تعداد کربن برابری دارند، به شرطی که هر دو یک عاملی باشند و گروه هیدروکربنی متصل به آنها سیر شده باشد، ایزومر یکدیگرند؛ یعنی با این که فرمول عمومی آلدهیدها و کتون ها با گروه هیدروکربنی سیرشده با n کربن، یکسان و به صورت CnH2nO است، اما ساختار متفاوت دارند.
آلدهیدها و کتون ها در طبیعت | معلم خصوصی شیمی در اصفهان
آلدهیدها و کتون هایی که کتاب شیمی یازدهم به آنها اشاره شده است عبارتند از:
2- الکل ها و اترها | معلم خصوصی شیمی در اصفهان
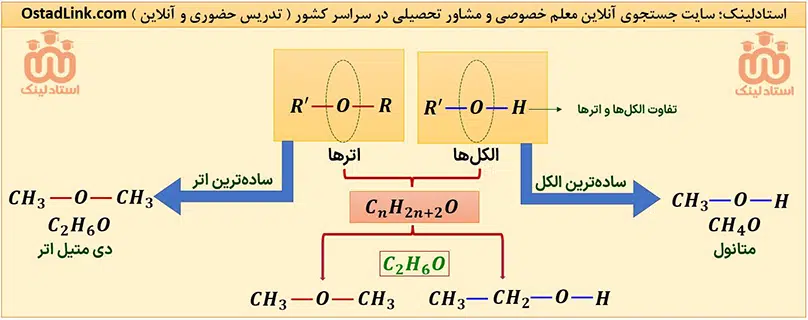
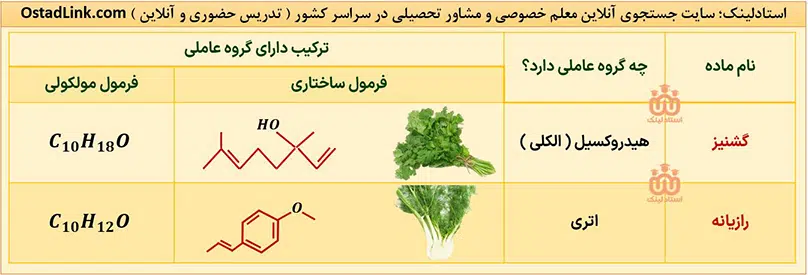
گروه هایی که در آنها اتم اکسیژن به یک یا دو اتم کربن با پیوند یگانه متصل است، به ترتیب هیدروکسیل (OH-) و گروه اتری (-O-) نام دارند؛ بنابراین مهم ترین تفاوت گروه هیدروکسیل و گروه اتری، وجود اتم هیدروژن متصل به اکسیژن در گروه هیدروکسیل است.
توجه: الکل ها ترکیب هایی هستند که در ساختار خود، یک یا چند گروه هیدروکسیل دارند.
- ساده ترین الکل، یک اتم کربن (CH3OH) و ساده ترین اتر، دو اتم کربن (CH3-O-CH3) دارد.
- الکل ها و اترهایی که تعداد کربن برابر دارند به شرطی که هر دو یک عاملی و سیرشده باشند، ایزومر یکدیگرند. فرمول عمومی الکل ها و اترهای یک عاملی سیرشده با n کربن به صورت CnH2n+2O است.
الکل ها و اترها در طبیعت | معلم خصوصی شیمی در اصفهان
الکل ها و اترهایی که کتاب شیمی یازدهم به آنها اشاره شده است عبارتند از:
فرمول تعداد اتم های هیدروژن و پیوند اشتراکی در ترکیب آلی
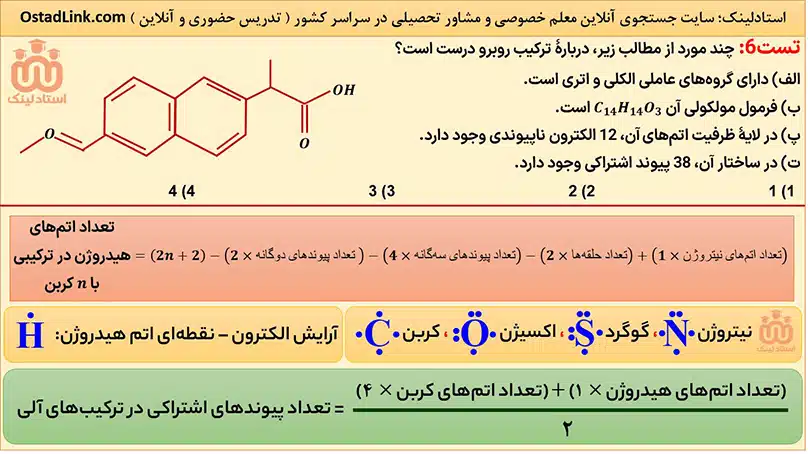
در تصویر بالا:
- فرمول تعداد اتم های هیدروژن در ترکیب آلی با n اتم کربن را مشاهده می کنید.
- فرمول تعداد پیوندهای اشتراکی در یک ترکیب آلی را مشاهده می کند.
15- ارزش سوختی مواد غذایی | معلم خصوصی شیمی
بدن ما مواد گوناگونی شامل کربوهیدرات ها، چربی ها، پروتئین ها، آب، ویتامین ها و مواد معدنی را از غذا دریافت می کند. در این میان، کربوهیدرات ها، چربی ها و گروتئین ها علاوه بر تأمین مواد اولیۀ سوخت و ساز سلول ها، منابعی برای تأمین انرژی آنها نیز هستند. برای بیان انرژی موجود در مواد غذایی از کمیتی به نام «ارزش سوختی» یا «ارزش غذایی» استفاده می شود.
ارزش سوختی یک مادۀ غذایی، مقدار انرژی است که از اکسایش کامل یک گرم مادۀ غذایی حاصل می شود و یکای آن معمولاً برحسب کیلوژول بر گرم (kJ.gr-1) بیان می شود.
توجه شود که ارزش سوختی کربوهیدارت ها با پروتئین ها برابر بوده و ارزش سوختی چربی بیش از دو برابر این دو مادۀ غذایی است.
ادامه دارد…
تدریس خصوصی شیمی در اصفهان | معلم خصوصی شیمی

برای موفقیت در امتحانات شیمی یازدهم، شیمی کنکور و امتحان نهایی شیمی، می توانید از کلاس های خصوصی شیمی ( معلم خصوصی شیمی ) سایت تدریس خصوصی استادلینک استفاده نمایید.
استادلینک با داشتن بهترین اساتید دروس مختلف در سراسر کشور و همچنین برگزاری کلاس های حضوری و آنلاین و ارائه بهترین خذمات با مناسب ترین هزینه، همواره در کنار شما دانش آموزان و داوطلبان کنکور سراسری است.
برای آگاهی از شرایط ثبت نام و جزئیات بیشتر به پشتیبانی سایت تدریس خصوصی استادلینک پیام دهید تا به شما مشاوره مناسب داده شود.
مقالات مرتبط فصل ۲ آموزش شیمی یازدهم
با کلیک بر روی هر بخش زیر، می توانید به آموزش خط به حط شیمی ۲ بخش های مختلف فصل ۲ دسترسی داشته باشید.
| بخش صفر آموزش شیمی یازدهم – اهمیت شیمی در کنکور سراسری |
| بخش ۱ آموزش شیمی یازدهم – ظرفیت گرمایی و گرمای ویژه |
| بخش ۲ شیمی یازدهم – واکنش گرماده – گرماگیر – آنتالپی |
| بخش چهارم آموزش خط به خط شیمی یازدهم |
| بخش پنجم آموزش خط به خط شیمی یازدهم |
| بخش ششم آموزش خط به خط شیمی یازدهم |




















یک پاسخ
عالی تشکر