این بخش شامل قسمت های زیر است:
26- آرایش الکترون_نقطه ای اتم ها
27- یون های پایدار برخی عنصرهای جدول دوره ای
28- آرایش الکترونی یون ها
29- ترکیب های یونی
30- تبدیل اتم ها به مولکول ها
26- آرایش الکترون _ نقطه ای اتم ها
| دانلود جزوه تمامی فرمول های شیمی |
گازهای نجیب در طبیعت به شکل تک اتمی یافت می شوند. این واقعیت نشان دهندۀ این است که گازهای نجیب واکنش ناپذیر بوده یا واکنش پذیری بسیار کمی دارند و پایدارند. این عنصرها ( به جز هلیم ) دارای 8 الکترون در لایۀ ظرفیت خود هستند؛ بنابراین می توان نتیجه گرفت اگر لایۀ ظرفیت اتمی هشت تایی و یا همانند آرایش گاز نجیب هلیم ( 1s2 ) باشد، آن اتم واکنش پذیری چندانی ندارد و اگر لایۀ ظرفیت اتمی همانند آرایش الکترونی یک گاز نجیب نباشد، آن اتم واکنش پذیر است.
آقای لوویس برای توضیح و پیش بینی رفتار اتم ها، آرایشی به نام آرایش الکترون_نقطه ای پیشنهاد کرد که در آن الکترون های ظرفیت هر اتم به صورت نقطه در اطراف نماد شیمیایی عنصر قرار می گیرند.
برای رسم آرایش الکترون_نقطه ای یک اتم، ابتدا نماد عنصر مربوطه را نوشته، سپس نقطه گذاری را از یک سمت نماد شیمیایی عنصر آغاز می کنیم. ابتدا در همۀ جهت ها ( بالا، راست، پایین و چپ ) یک نقطه که نشان دهندۀ یک تک الکترون است، قرار داده و در صورت وجود الکترون بیشتر، نقطه را جفت می کنیم.

27- یون های پایدار برخی از عنصرهای جدول دوره ای
اتم ها می توانند با از دست دادن، گرفتن یا به اشتراک گذاشتن الکترون، به آرایش یک گاز نجیب برسند و پایدارتر شوند. در واقع از دست دادن، گرفتن یا به اشتراک گذاشتن الکترون، نشانه ای از رفتار شیمیایی اتم است.
در این قسمت با از دست دادن یا گرفتن الکترون و تشکیل یون سروکار داریم.
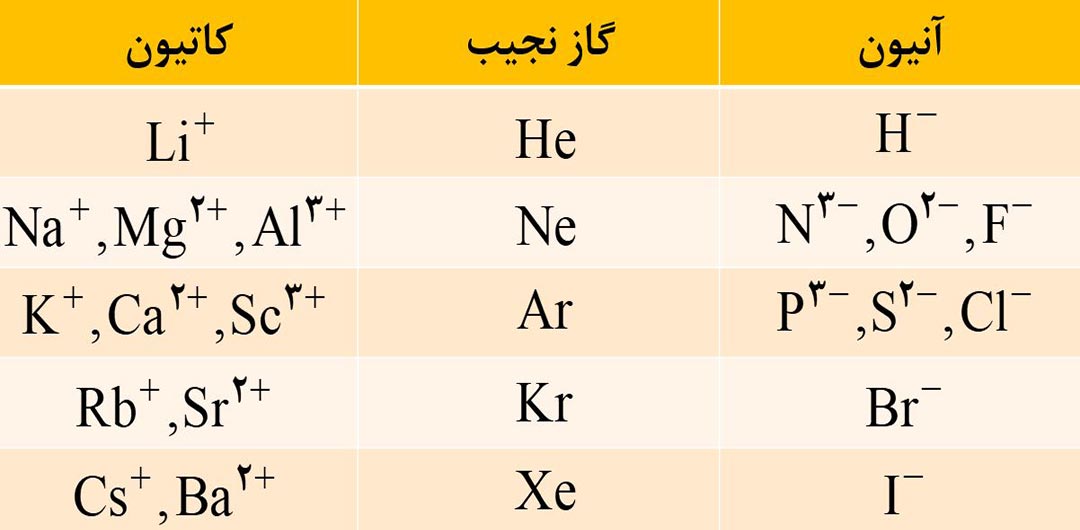
به طور کلی اتم عنصرهای گروه 1 و 2 در شرایط مناسب، به ترتیب با از دست دادن یک و دو الکترون به کاتیونی تبدیل می شوند که آرایشی همانند آرایش الکترونی گاز نجیب پیش از آنها را دارد.
مثال: اتم لیتیم ( 3Li ) از گروه 1 با تشکیل یون +3Li به آرایش گاز نجیب هلیم ( 2He ) و اتم 20Ca از گروه 2 با تشکیل یون +2 20Ca به آرایش گاز نجیب آرگون (18Ar) می رسد.
توجه: اتم بریلیم ( Be ) در گروه دوم، یون +2 Be تشکیل نمی دهد و به جای از دست دادن الکترون، با به اشتراک گذاشتن الکترون در واکنش ها شرکت می کند.
توجه: اتم بور ( 5B ) در گروه 13 تمایلی به تشکیل یون +3 B ندارد و به جای آن الکترون به اشتراک می گذارد. دیگر عنصرهای گروه 13، یون سه بار مثبت تشکیل می دهند، اما به آرایش گاز نجیب نمی رسند؛ البته به جز آلومینیم ( Al ).
نکته: آلومینیم در گروه 13 می تواند با از دست دادن 3 الکترون و تبدیل شدن به یون +3 Al، به آرایش گاز نجیب قبل از خود یعنی 10Ne برسد.
عنصرهای Si ، C و Ge در گروه 14، به جای از دست دادن یا گرفتن الکترون، الکترون به اشتراک می گذارند؛ بنابراین در گروه چهاردهم یون
+4 A و -4 A نداریم.
توجه: به طور کلی در صورتی که تعداد الکترون های ظرفیت اتمی کمتر یا برابر 3 باشد، آن اتم در شرایط مناسب تمایل دارد که همۀ الکترون های ظرفیت خود را از دست بدهد و به کاتیون تبدیل شود.
عنصرهای گروه 15 با آرایش لایۀ ظرفیت ns2np3 می توانند سه الکترون بگیرند و با تبدیل شدن به یون منفی با فرمول کلی -3 A به آرایش هشت تایی پایدار گاز نجیب پس از خود برسند.
عنصرهای گروه 16 با آرایش لایۀ ظرفیت ns2np4 می توانند دو الکترون بگیرند و با تبدیل شدن به یون منفی با فرمول کلی -2 A به آرایش هشت تایی پایدار گاز نجیب پس از خود برسند.
عنصرهای گروه 17 با آرایش لایۀ ظرفیت ns2np5 می توانند یک الکترون بگیرند و با تبدیل شدن به یون منفی با فرمول کلی – A به آرایش هشت تایی پایدار گاز نجیب پس از خود برسند.
توجه: اتم عنصرهای گروه 15، 16 و 17 در شرایط مناسب با گرفتن الکترون به آنیون هایی تبدیل می شوند که آرایشی همانند آرایش الکترونی گاز نجیب پس از خود ( هم دورۀ خود ) را دارند.
جمع بندی یون های پایدار:

28- آرایش الکترونی یون ها
توجه: حتماً در این بخش، زمانی که می خواهیم آرایش اتم خنثی را به آرایش یون تبدیل کنیم، از آرایش الکترونی اصلاح شده استفاده کنید. در مابقی حالات، حتماً از آرایش اصلاح نشده، برای سادگی، استفاده می کنیم.
1- آرایش الکترونی یون های مثبت ( کاتیون ها ):
ابتدا آرایش الکترونی اصلاح شدۀ اتم موردنظر را رسم کرده و سپس به تعداد بار یون، از زیرلایه ای که با بزرگترین عدد کوانتومی اصلی ( n )، یا همان آخرین لایه در آرایش اصلاح شده، الکترون جدا میکنیم و اگر الکترون های زیر لایۀ آخر تمام شد، به سراغ الکترون های لایۀ قبل تر آن می رویم. ( در این حالت از آرایش اصلاح شده استفاده می کنیم ).
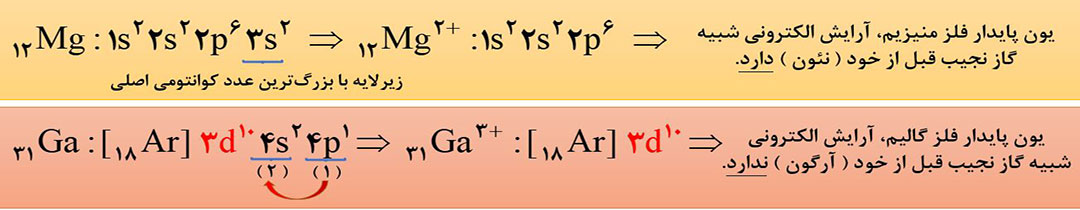
توجه: اگر آرایش الکترونی کاتیون داده شود، و بخواهیم آن را به آرایش الکترونی اتم تبدیل کنیم، کافی است که به تعداد بار و به ترتیب پرشدن زیرلایه ها، به آن الکترون اضافه کنیم. ( در این حالت، از آرایش اصلاح نشده استفاده می کنیم ).

2- آرایش الکترونی یون های منفی ( آنیون ):
ابتدا آرایش الکترونی اصلاح شدۀ اتم را بنویسید و سپس به تعداد بار یون، به آخرین زیرلایۀ الکترونی، الکترون اضافه می کنیم.

توجه: اگر آرایش الکترونی آنیون داده شود و بخواهیم آنرا به آرایش الکترونی اتم تبدیل کنیم، کافی است به تعداد بار، از آخرین زیرلایۀ الکترونی، الکترون حذف کنیم.

چند نکته در مورد آرایش الکترونی کاتیون ها و آنیون ها
1- همۀ یون های منفی ( آنیون ها ) به آرایش پایدار گاز نجیب بعد از خود می رسند، ولی در کاتیون ها، فقط کاتیون های پایدار فلزهای گروه 1 و 2 و 3 و آلومینیوم
( Al ) به آرایش گاز نجیب می رسند.
توجه: اغلب کاتیون های عنصرهای دستۀ d برخلاف عنصرهای دستۀ s، بدون رسیدن به آرایش الکترونی گاز نجیب به پایداری می رسند. به طور مثال آهن می تواند یون +2 26Fe را تشکیل دهد، اما این یون به آرایش گاز نجیب نمی رسد. البته عنصرهای گروه 3 که به دستۀ d تعلق دارند، می توانند، با تشکیل یون +3 به آرایش الکترونی گاز نحیب دورۀ قبل از خود برسند.
2- از آنجا که اتم ها می توانند با از دست دادن یا گرفتن الکترون به آرایش الکترونی گازهای نجیب برسند، نتیجه میگیریم که:
الف) آرایش الکترونی ns2np6 می تواند مربوط به اتم گاز نجیب، یک کاتیون پایدار و یا یک آنیون پایدار باشد.
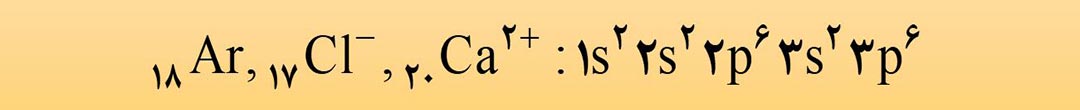
ب) آرایش الکترونی 1s2 میتواند مربوط به آرایش یک اتم خنثی ( هلیم )، یک یون مثبت (+3Li) و یا یک یون منفی (–1H) باشد.
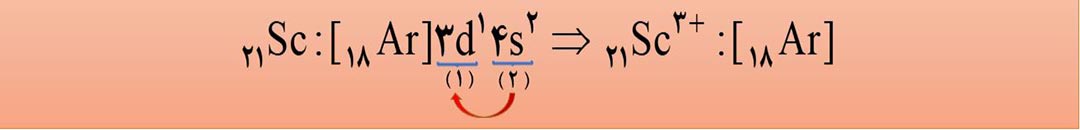
3- اگر در یک آرایش الکترونی، زیرلایۀ 3d وجود داشته باشد ولی زیرلایۀ 4s وجود نداشته باشد، آن آرایش الکترونی فقط و فقط می تواند مربوط به یک یون مثبت (کاتیون) باشد. به طور مثال 18Ar] 3d10 ] فقط می تواند مربوط به یک کاتیون باشد؛ زیرا در اتم های خنثی، زیرلایۀ 4s زودتر از زیرلایۀ 3d اشغال
می شود. پس حالا که 4s را نداریم، یعنی الکترون های خود زا از دست داده است پس قطعاً با یک کاتیون سروکار داریم.
29- ترکیب های یونی
برخی مواقع، دو نوع اتم که در شرایط مناسب در کنار هم قرار می گیرند، با هم الکترون دادوستد می کنند، به طوری که یکی به یون مثبت و دیگری به یون منفی تبدیل می شود. در این مواقع میان یون های تولید شده به دلیل وجود بارهای الکتریکی ناهمنام، نیروی جاذبۀ بسیار قوی برقرار می شود که به آن پیوند یونی و به ترکیب حاصل، ترکیب یونی می گویند.
مثال: هرگاه اتم های سدیم و کلر کنار یکدیگر قرار می گیرند، اتم سدیم با از دست دادن یک الکترون به یون (+Na) و اتم کلر با گرفتن یک الکترون به یون کلرید (–Cl) تبدیل و در این واکنش، ترکیب یونی سدیم کلرید ( نمک خوراکی ) تشکیل می شود.
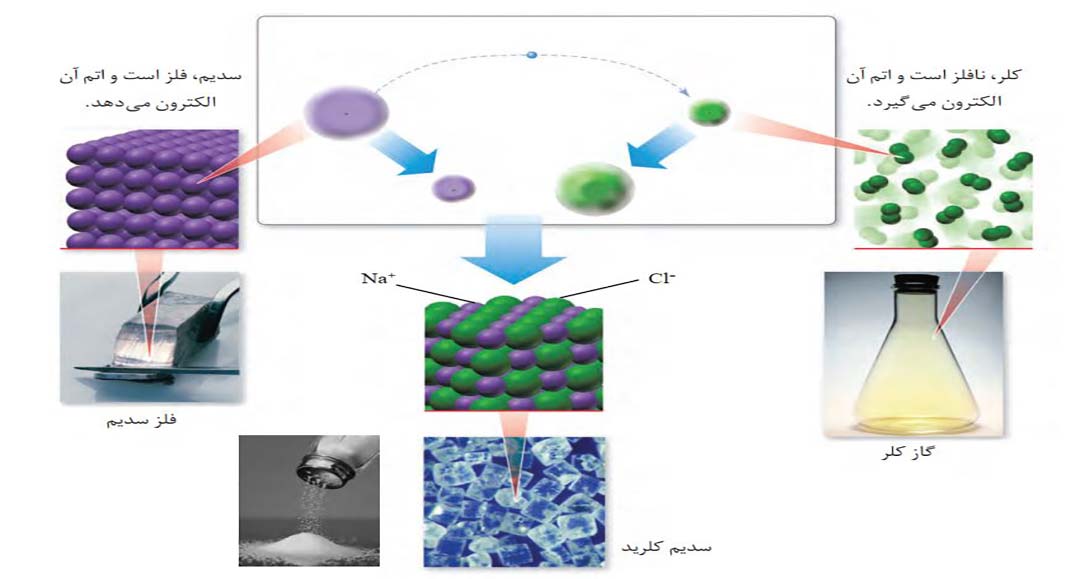
با توجه به عکس بالا خواهیم داشت:
1- فلز سدیم بسیار نرم است به طوری که با چاقو بریده می شود.
2- گاز کلر، گازی زردرنگ است.
3- اندازۀ (شعاع) یون +Na از اتم Na کوچکتر و اندازۀ (شعاع) یون –Cl از اتم Cl بزرگ تر است.
چند نکته در مورد ترکیب های یونی:
1) ترکیب های یونی شامل تعداد بسیار زیادی یون با آرایش منظم هستند که ذر ساختار آنها مولکولی وجود ندارد؛ از این رو به کار بردن واژۀ مولکول برای آنها غلط است.
2) به کاتیون و آنیونی که تنها از یک اتم تشکیل شده باشد، یون تک اتمی می گویند؛ مانند +Na و –Cl و -3 N و ….
توجه: هر یونی که از یک نوع اتم تشکیل شده باشد، لزوماً تک اتمی نیست؛ به طور مثال یون -2 O2 تنها از یک نوع اتم (O) تشکیل شده است، ولی تک اتمی به شمار نمی آید؛ زیرا دارای دو اتم می باشد
3) برای نام گذاری کاتیون های تک اتمی ( که تنها یک نوع بار دارند )، پیش از نام عنصر، کلمۀ یون را اضافه کنید.
4) برای نام گذاری آنیون های تک اتمی، علاوه بر به کار بردن کلمۀ یون قبل از آنیون، به انتهای نام نافلز (یا ریشۀ نام آن) پسوند «ید» اضافه می کنیم.

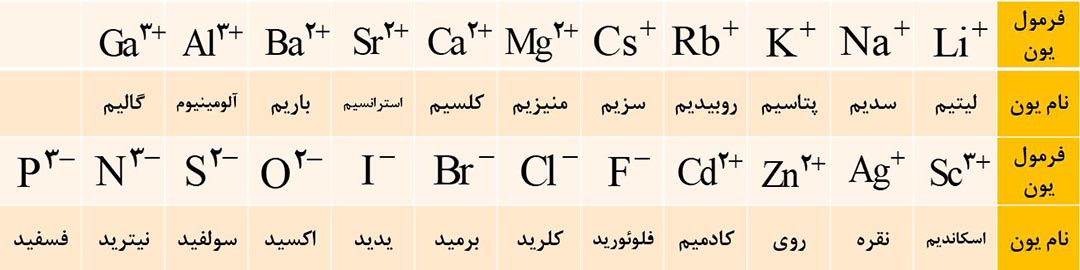
فرمول و نام مهم ترین یون های تک اتمی که تا اینجا باید بلد باشید را در تصویر زیر مشاهده کنید.
30- تبدیل اتم ها به مولکول ها
همانطور که قبلاً گفتیم، یکی از روش های رسیدن به آرایش پایدار گاز نجیب، به اشتراک گذاشتن الکترون است. پیوندی که ناشی از به اشتراک گذاشتن الکترون بین دو اتم است، پیوند اشتراکی یا کووالانسی نامیده می شود. در مولکول ها به جای این که الکترون دادوسند شود، الکترون به اشتراک گذاشته می شود.
مثال: گاز کلر که خاصیت رنگ بری و گندزدایی دارد، از مولکول دواتمی Cl2 تشکیل شده است.
در آرایش الکترون-نقطه ای اتم کلر، یک الکترون جفت نشده وجود دارد؛ بنابراین هر اتم کلر به دنبال آن است که تک الکترون خود را با تک الکترون اتم کلر دیگر به اشتراک بگذارد تا هر دو به آرایش هشت تایی برسند. با تشکیل مولکول Cl2، دو الکترون موجود بین دو اتم، به هردوی آنها تعلق دارد. به این جفت الکترون اشتراکی، پیوند اشتراکی (کووالانسی) می گویند.
برای مشاهدۀ ساختار گاز کلر، ویدئوی انتهای فصل را مشاهده نمایید.
چند نکته در مورد ترکیب های مولکولی
1) به مواد شیمیایی که در ساختار خود مولکول دارند، مواد مولکولی می گویند. این مواد مولکولی هم می توانند به صورت عنصر باشند، مثل Cl2 و O2 و … و هم به صورت ترکیب، مثل H2O و HCl و…
2) پیوند اشتراکی (کووالانسی) معمولاً بین اتم های نافلز تشکیل می شود؛ به طور مثال پیوند بین N و O از نوع اشتراکی است؛ یعنی این دو اتم ، با هم، ترکیب مولکولی تشکیل می دهند. درحالی که قبلاً دیدیم از واکنش یک فلز و یک نافلز ( مانند NaCl )، ترکیب یونی تشکیل می شود.
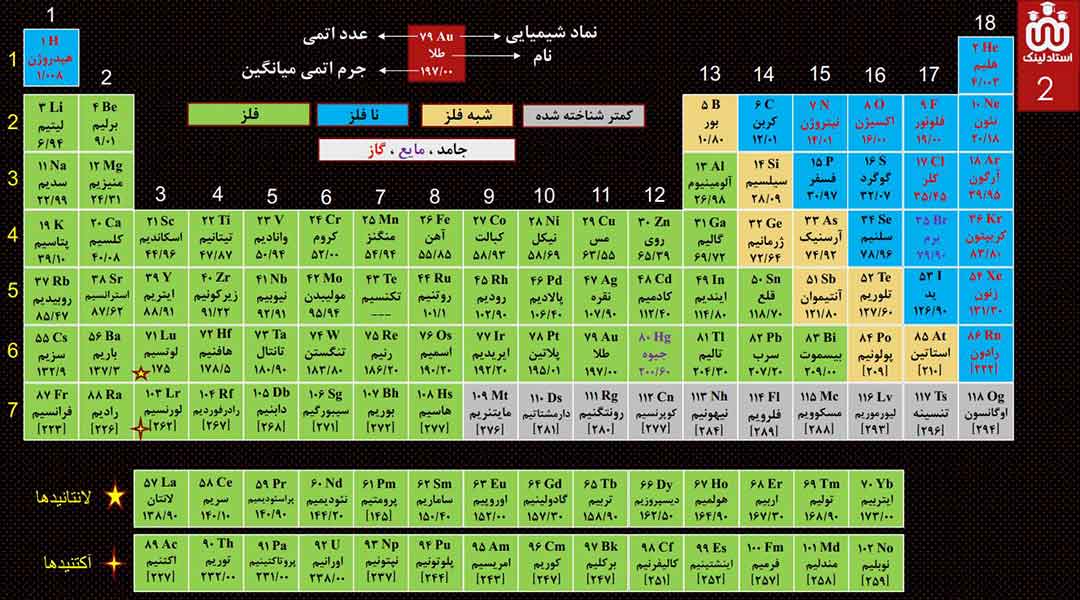
برای دانلود PDF جدول تناوبی، تهیه شده توسط تیم استادلینک، اینجا کلیک کنید.
3) هر اتم هیدروژن، در لایۀ ظرفیت خود یک الکترون دارد و نیاز به یک الکترون دیگر دارد تا به آرایش پایدار دوتایی (شبیه هلیم) برسد؛ بنابراین اتم هیدروژن تنها می تواند یک پیوند اشتراکی تشکیل دهد. ( H. )
4) به پیوند کووالانسی که در نتیجۀ به اشتراک گذاشتن دو جفت الکترون میان دو اتم تشکیل می شود، پیوند دوگانه می گویند. در پیوند دوگانه (=)، هر خط معادل 2 الکترون و این پیوند در مجموع معادل 4 الکترون اشتراکی است.
5) به پیوند کووالانسی که در نتیجۀ به اشتراک گذاشتن 3 جفت الکترون، میان دو اتم تشکیل می شود، پیوند سه گانه می گویند. این پیوند در مجموع معادل 6 الکترون (6=2*3) است.
با توجه به آرایش الکترون-نقطه ای اتم ها، به راحتی می توان آرایش الکترون-نقطه ای مولکول ساده را رسم کرد. آرایش الکترون- نقطه ای همۀ مولکول هایی که شما باید در این فصل بلد باشید، در ویدئوی آموزشی آمده است.
توجه: عنصرهای گروه 13 تا 17 می توانند با هیدروژن ترکیب مولکولی تشکیل دهند. در ویدئوی آموزشی، به ساختار متان، آمونیاک و آب توجه کنید.
به فرمول شیمیایی مولکول ها که علاوه بر نوع عنصرهای سازنده، شمار اتم های هر عنصر را نشان می دهد، فرمول مولکولی می گویند؛ به طور مثال فرمول مولکولی آب H2O و فرمول مولکولی آمونیاک NH3 است.
مدل فضاپرکن، روشی برای نمایش سه بُعدی مولکول است که در آن اتم ها به صورت گوی های کُروی شکل نمایش داده می شوند و به کمک آن علاوه بر نوع عنصرها، شمار اتم های هر عنصر و نحوۀ قرارگیری اتم ها نسبت به هم نیز مشخص می شود. در این مدل، تعداد پیوندهای اشتراکی نشان داده نمی شود.
توجه: در مولکول آب، سه اتم موجود، در امتداد یک خط راست قرار ندارند؛ به عبارت دیگر شکل مولکول آب، خمیده ( V شکل ) است. دلیل این امر را در فصل 3 خواهیم آموخت.
آموزش ویدئویی ترکیبات یونی و کووالانسی
دانلود سوالات امتحانی شیمی دهم فصل اول
برای دانلود سوالات سری اول شیمی 1 پایه دهم فصل اول، اینجا ضربه بزنید.
برای دانلود پاسخ تشریحی نمونه سوالات سری اول، اینجا ضربه بزنید.
برای دانلود سؤالات سری دوم شیمی 1 ( مسائل )، اینجا ضربه بزنید.
برای دانلود پاسخ مساول سری دوم، اینجا کلیک کنید.
مقالات مرتبط فصل1 شیمی1
فصل1 – بخش صفر – اهمیت شیمی در کنکور سراسری
فصل1 – بخش اول – تبدیل واحدها – رابطۀ انیشتین
فصل1 – بخش دوم – ذرات زیر اتمی – ایزوتوپ ها
فصل1 – بخش سوم – جرم اتمی میانگین – آشنایی با جدول تناوبی
فصل1 – بخش چهارم – مول چیست؟ – آموزش استوکیومتری
فصل1 – بخش پنجم – نور کلید شناخت جهان هستی – طیف نشری هیدروژن



















