این بخش شامل قسمت های زیر است:
5) عدد اتمی و عدد جرمی
6) ایزوتوپ ها
7) رادیو ایزوتوپ ها
8) ایزوتوپ های هیدروژن
9) تکنسیم، نخستین عنصر ساخت بشر
10) کاربرد برخی از رادیوایزوتوپ ها
5- عدد اتمی و عدد جرمی
| دانلود جزوه تمامی فرمول های شیمی |
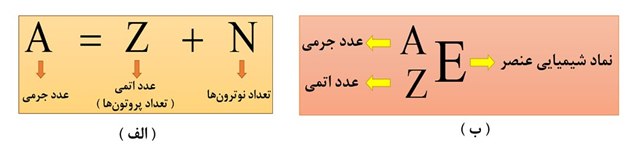
به تعداد پروتون های هستۀ اتم هر عنصر، عدد اتمی گفته می شود و آن را با نماد Z نشان می دهند. عدد اتمی هر عنصر، منحصر به فرد است؛ پس خیلی راحت به کمک عدد اتمی، نوع عنصر تعیین می گردد. به طور مثال عدد اتمی 6 فقط مربوط به عنصر کربن ( C ) است.
به مجموع تعداد پروتون ها و نوترون های یک اتم، عدد جرمی گفته می شود و آنرا با نماد A نشان می دهند.
نکات مهم ذرات زیر اتمی
نکتۀ1) اتم، ذره ای خنثی است؛ بنابراین تعداد پروتون های یک اتم با تعداد الکترون های آن برابر است. در واقع در یک اتم خنثی، عدد اتمی، تعداد الکترون ها را هم تعیین می کند.
نکتۀ2) در یون های مثبت ( کاتیون ها )، تعداد الکترون ها به اندازۀ بار مثبت از تعداد پروتون ها، کمتر است.
نکتۀ3) در یون های منفی ( آنیون ها )، تعداد الکترون ها به اندازۀ بار مثبت از تعداد پروتون ها، بیشتر است.

توجه: تعداد پروتون ها و نوترون ها در اتم ها و یون های مربوط به آن، هیچ فرقی با هم نمی کند.
ادامه نکات ذرات زیراتمی
نکتۀ4) برای بدست آوردن تعداد پروتون ها و نوترون ها در گونه های چنداتمی، کافی است تعداد پروتون ها و نوترون های هر یک از اتم ها را با هم جمع کنیم. برای محاسبۀ تعداد الکترون ها در این گونه ها، اگر گونۀ مورد نظر خنثی بود ( مثلا H2O )، تعداد الکترون ها با تعداد پروتون ها برابر خواهد بود. اگر گونۀ چنداتمی، یون بود، با توجه به مثبت یا منفی بودن بار آن، به تعداد بار از تعداد پروتون ها کم ( برای یونهای مثبت ) و یا اضافه ( برای یونهای منفی ) می شود تا تعداد الکترون ها بدست آید.
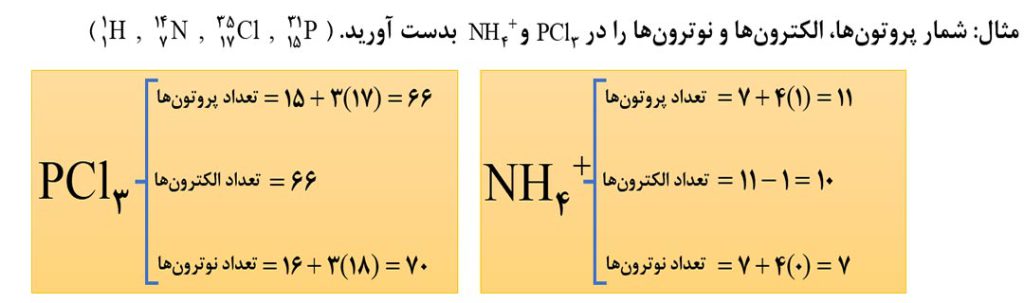
نکتۀ5) در همۀ اتم ها به جز هیدروژن معمولی ( H )، تعداد نوترون ها برابر یا بیشتر از تعداد پروتون ها است. بنابراین در مسائلی که تفاوت شمار نوترون ها و پروتون ها را به ما می دهند ( مثلا عدد x )، باید بنویسیم N-Z=x .
تمرین1) اگر تفاوت شمار نوترون و پروتون های هستۀ عنصر A برابر با 3 و عدد جرمی آن 45 باشد، تعداد تمام ذرات زیر اتمی آنرا بدست آورید.
نکتۀ6) در برخی از مسائل تفاوت شمار نوترون ها و الکترون ها را به ما می دهند. واضح است که در اتم های خنثی و کاتیون ها، شمار نوترون ها از شمار الکترون ها بیشتر است و باز هم مانند نکتۀ قبل باید بنویسیم N-e=x .
در آنیون ها قضیه کمی متفاوت است. تعداد نوترون ها می تواند برابر، کمتر و با بیشتر از تعداد الکترون ها باشد. در حالت کلی باید هر دو رابطۀ N-e=x و e-N=x را در مسئله امتحان کنیم. توجه شود حالتی درست است که تعداد نوترون ها بیشتر یا مساوی تعداد پروتون ها بدست آید.
توجه: در یک نوع خاص از مسائل می توانیم از قاعدۀ زیر استفاده کنیم:
« اگر اختلاف تعداد نوترون ها و الکترون ها در یک یون منفی بیشتر از مقدار بار یون باشد، حتما تعداد نوترون ها بیشتر از تعداد الکترون ها است. » یعنی در حل این مسائل از N-e=x استفاده کنید.
تمرین2) اگر اختلاف تعداد الکترون ها و نوترون ها در یون دوبار منفی A برابر 9 و عدد جرمی آن 79 باشد، تعداد ذرات زیر اتمی آنرا بدست آورید.
ویدئوی آموزشی ذرات زیراتمی
6- ایزوتوپ ها
به اتم های یک عنصر که عدد اتمی (Z) یکسان و عدد جرمی (A) متفاوت دارند، ایزوتوپ می گویند.
ایزوتوپ به معنای هم مکان است. به این معنی که همۀ ایزوتوپ های یک عنصر به علت داشتن عدد اتمی یکسان، دارای خواص شیمیایی یکسانی هستند و به یک خانه از جدول دوره ای تعلق دارند.
شباهت های ایزوتوپ ها
الف) عدد اتمی ( تعداد پروتون ها ) – ب) تعداد الکترون ها و موقعیت آنها در جدول دوره ای – پ) خواص شیمیایی
تفاوت های ایزوتوپ ها
الف) تعداد نوترون ها – ب) عدد جرمی – پ) خواص فیزیکی وابسته به جرم مانند چگالی، نقطۀ ذوب و جوش – ت) میزان فراوانی در طبیعت و پایداری
نکات مهم ایزوتوپ ها
نکتۀ1) جلوتر خواهیم آموخت که جرم یک اتم به طور عمده وابسته به تعداد پروتون ها و نوترون ها است. با توجه به تفاوت تعداد نوترون های ایزوتوپ های یک اتم، جرم ایزوتوپ ها با هم متفاوت است. به همین دلیل، اغلب در یک نمونۀ طبیعی از یک عنصر، به دلیل وجود ایزوتوپ ها، اتم های سازنده جرم یکسانی ندارند.
نکتۀ2) با توجه به اینکه جرم ایزوتوپ ها با هم فرق می کند، خواص فیزیکی وابسته به جرم مانند چگالی، نقطۀ ذوب و جوش ایزوتوپ ها با هم متفاوت است.
نکتۀ3) با توجه به یکسان بودن خواص شیمیایی ایزوتوپ ها، برای جداسازی ایزوتوپ ها از یکدیگر، روش های شیمیایی کارایی ندارد و باید از روش های فیزیکی وابسته به جرم استفاده کرد.
نکتۀ4) فراوانی ایزوتوپ های یک عنصر در طبیعت یکسان نیست. فعلاً در حد کتاب درسی و کنکور بدانید، ایزوتوپی که فراوانی بیشتری دارد، پایدارتر است. در کتاب درسی به ایزوتوپ های طبیعی چند عنصر زیر اشاره شده است که بهتر است این جدول را بخاطر بسپارید.

نکتۀ5) درصد فراوانی هر یک از ایزوتوپ ها در یک نمونه را می توان بصورت زیر محاسبه کرد:

7- رادیوایزوتوپ ها
برخی ایزوتوپ ها ناپایدارند. یعنی هستۀ آنها ماندگار نیست و با گذشت زمان به صورت خود به خود، متلاشی می شوند. این ایزوتوپ ها، پرتوزا بوده و اغلب بر اثر متلاشی شدن، علاوه بر ذره های پرانرژی، مقدار زیادی انرژی نیز آزاد می کنند. به ایزوتوپ های پرتوزا و ناپایدار، رادیوایزوتوپ گفته می شود.
نکتۀ1) اغلب هسته هایی که نسبت شمار نوترون ها به پرتون های آنها برابر یا بیشتر از 1/5 باشند، ناپایدارند.
توجه: جملۀ بالا به این معنی نیست که همۀ هسته هایی که نسبت نوترون به پروتون آنها کمتر از 1/5 است، قطعا پایدارند. بعنوان مثال عنصر تکنسیم که در تصویربرداری پزشکی به کار می رود، با اینکه نسبت نوترون به پروتون کمتر ار 1/5 دارد، ولی ناپایدار و پرتوزا است.
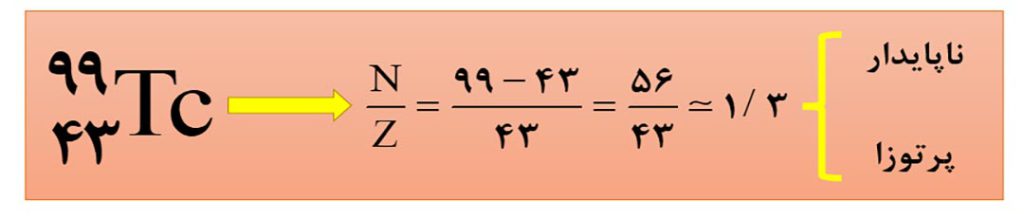
بازی و ریاضی
در تصویر زیر انواع حالاتی که برای نسبت نوترون به پروتون می تواند بیان شود، ذکر شده است.
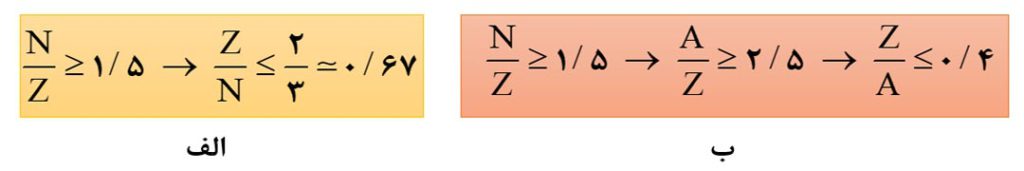
نکتۀ2) یکی از کمیت هایی که نشان می دهد یک ایزوتوپ تا چه اندازه پایدار است، نیم عمر است. نیم عمر مدت زمانی است که طی آن نیمی از ایزوتوپ موجود متلاشی می شود. هرچقدر که نیم عمر یک ایزوتوپ کوتاه تر باشد، در زمان کمتری متلاشی می شود؛ پس ناپایدارتر است.
8- ایزوتوپ های هیدروژن
هیدروژن دارای 7 ایزوتوپ است. سه ایزوتوپ سبک تر آن طبیعی و 4 ایزوتوپ سنگین تر آن، ساختگی هستند.
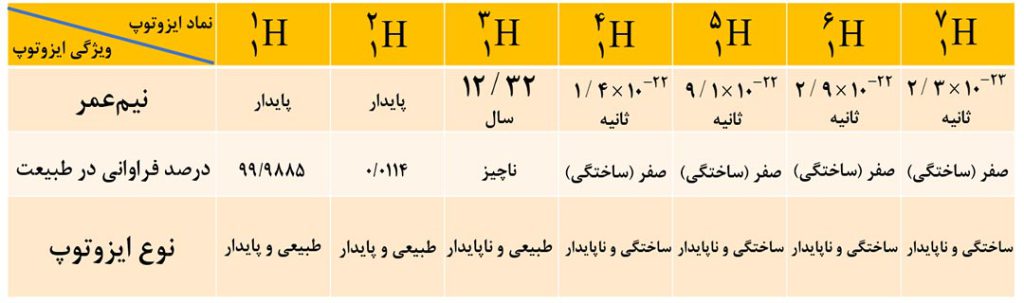
نکات مربوط به ایزوتوپ های هیدروژن
1- یک نمونۀ طبیعی از عنصر هیدروژن، مخلوطی از سه ایزوتوپ اول است.
2- در بین ایزوتوپ های طبیعی هیدروژن، دوتای اول پایدار هستند ولی سومی ناپایدار است.

3- مقایسۀ نیم عمر و پایداری ایزوتوپ های ساختگی هیدروژن را بخاطر بسپارید.

توجه: با افزایش عدد جرمی ایزوتوپ های هیدروژن، نیم عمر آنها به صورت منظم کاهش نمی یابد. به این ترتیب می توان گفت این جمله که « هرچه نسبت شمار نوترون ها و پروتون های یک ایزوتوپ بزرگتر باشد، آن ایزوتوپ ناپایدارتر است. » همیشه درست نیست!
4- هیدروژن دارای 5 رادیوایزوتوپ است.

سوالات مهم در مورد ایزوتوپ های هیدروژن
1- هیدروژن چند ایزوتوپ طبیعی دارد؟
2- هیدروژن چند ایزوتوپ پایدار است؟
3- هیدروژن چند ایزوتوپ پرتوزا دارد؟ نام ببرید.
4- هیدروژن چند ایزوتوپ پرتوزای طبیعی دارد؟
5- کدام ایزوتوپ هیدروژن از همه پایدارتر است؟
6- کدام ایزوتوپ پرتوزای هیدروژن از همه پایدارتر است؟
7- در بین ایزوتوپ های ساختگی هیدروژن، کدام از همه پایدارتر است؟
9- تکنسیم، نخستین عنصر ساخت بشر
تاکنون در جهان 118 عنصر شناخته شده است. 92 تای آنها در طبیعت یافت می شود و 26 عنصر آن در طبیعت وجود ندارد که ما انسان ها با کمک واکنش های هسته ای، به طور مصنوعی ساخته ایم.

نکات امتحانی عنصر تکنسیم
1- تکنسیم نخستین عنصری است که به طور مصنوعی در واکنشگاه ( راکتور ) هسته ای ساخته شده است.
2- تکنسیم در دوره ( ردیف = تناوب ) پنجم و گروه 7 جدول تناوبی قرار دارد.
3- از تکنسیم برای تصویربرداری غدۀ تیروئید استفاده می شود. یون یدید ( –I ) با یون حاوی تکنسیم که برای تصویربرداری غدۀ تیروئید استفاده می شود، اندازۀ مشابهی دارد و غدۀ تیروئید هنگام جذب یدید، این یون را هم جذب می کند. با افزایش مقدار این یون حاوی تکنسیم در غدۀ تیروئید، امکان تصویربرداری فراهم می شود. توجه شود که بیان شد یون حاوی تکنسیم نه یون تکنسیم!
4- همۀ تکنسیم موجود در جهان باید به طور مصنوعی و با استفاده از واکنش های هسته ای ساخته شود. بخاطر اینکه نیم عمر ( زمان ماندگاری ) این عنصر کم است، نمیتوان مقادیر زیادی از این عنصر را تهیه و برای مدت طولانی نگهداری کرد. بنابراین هر موقع لازم بود، باید به مقدار لازم آنرا با یک مُوَّلِد ( ژنراتور ) هسته ای تولید و سپس مصرف کنیم.
5- تکنسیم جزء اتم هایی است که نسبت شمار نوترون ها به پروتون های آن کمتر از 1/5 است، ولی با این وجود، ناپایدار بوده و رادیوایزوتوپ محسوب می شود.
10- کاربرد برخی از رادیوایزوتوپ ها
از رادیوایزوتوپ ها در پزشکی، کشاورزی و به عنوان سوخت در نیروگاه های اتمی استفاده می شود. کاربرد برخی رادیوایزوتوپ ها در تصویر زیر آمده است که بهتر است بخاطر بسپارید.
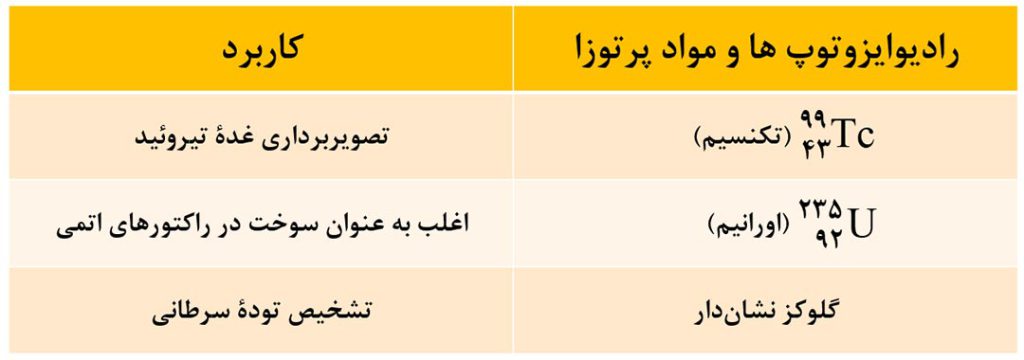
فراوانی اورانیم 235 در مخلوط ایزوتوپ های طبیعی اورانیم، کمتر از 0/7 درصد است. دانشمندان هسته ای ما با تلاش های بسیار موفق شدند مقدار آنرا در مخلوط ایزوتوپ های عنصر اورانیم افزایش دهند. به این فرایند که یکی از مراحل مهم چرخۀ تولید سوخت هسته ای است، غنی سازی ایزوتوپی می گویند.

پسماندهای راکتورهای اتمی هنوز خاصیت پرتوزایی دارند و خطرناک اند. به همین خاطر دفع این زباله ها، یکی از چالش های صنایع هسته ای به شمار می آید.
تعریف گلوکز نشان دار
به گلوکز حاوی اتم پرتوزا، گلوکز نشان دار می گویند. با تزریق گلوکز نشان دار به بیمار، علاوه بر گلوکز معمولی، گلوکز نشان دار هم در تودۀ سرطانی که رشد غیرعادی و سریع دارد، تجمع می کند. بنابراین آشکارساز می تواند پرتوهای آزاد شدۀ حاصل از اتم پرتوزا در این گلوکز را مشخص کرده و محل تودۀ سرطانی را در بدن، آشکار کند.
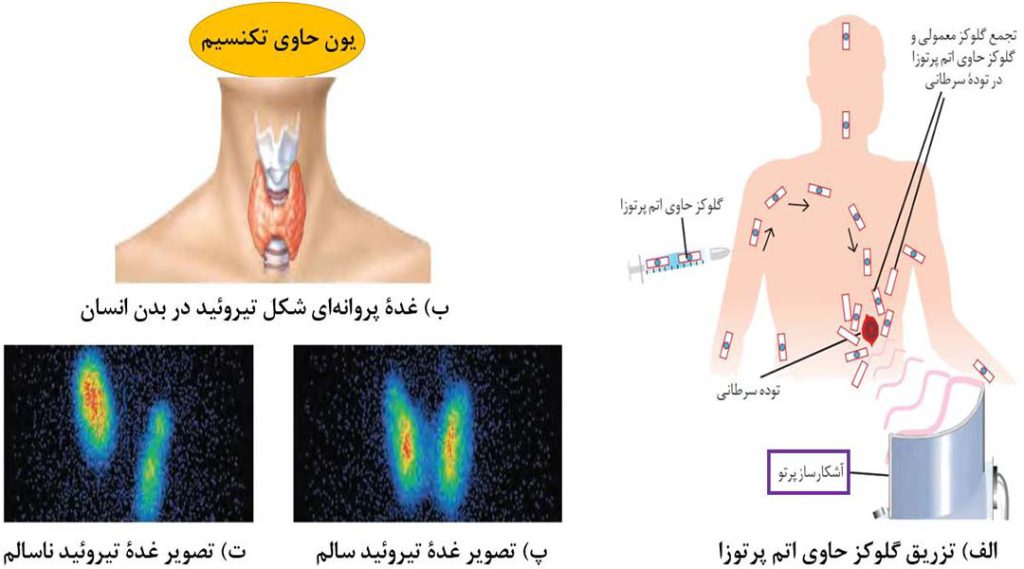
توجه: عنصرهای مس ( Cu ) و فسفر ( P ) هم در میان ایزوتوپ های خود، دارای ایزوتوپ پرتوزا هستند.
توجه: کیمیاگری یعنی تبدیل عنصرهای دیگر به طلا، که امروزه با پیشرفت علم شیمی و فیزیک امکان پذیر است، اما به دلیل زیاد بودن هزینۀ تولید آن، صرفۀ اقتصادی ندارد.
توجه: دود سیگار و قلیان، مقدار قابل توجهی مواد پرتوزا دارد. از این رو اغلب افرادی که به سرطان ریه دچار می شوند، سیگاری هستند.
برای ارسال تکالیف شیمی دهم بخش دوم، اینجا ضربه بزنید.
پایان بخش دوم آموزش خط به خط شیمی دهم فصل اول
مقالات مرتبط فصل1 شیمی1
فصل1 – بخش صفر – اهمیت شیمی در کنکور سراسری
فصل1 – بخش اول – تبدیل واحدها – رابطۀ انیشتین
فصل1 – بخش سوم – جرم اتمی میانگین – آشنایی با جدول تناوبی
فصل1 – بخش چهارم – مول چیست؟ – آموزش استوکیومتری
فصل1 – بخش پنجم – نور کلید شناخت جهان هستی – طیف نشری هیدروژن























یک پاسخ
تشکر و سپاس فراوان از استاد نجفی عزیز♥️