این بخش شامل قسمت های زیر است:
20- توزیع الکترون ها در لایه ها و زیر لایه ها
21- قاعدۀ آفبا 22- آرایش الکترونی گسترده و فشرده
23- الکترون های ظرفیت
24- تعیین موقعیت عنصرها در جدول دوره ای
25- دسته بندی عنصرها به s، p، d، f
20- توزیع الکترون ها در لایه ها و زیر لایه ها
| دانلود جزوه تمامی فرمول های شیمی |
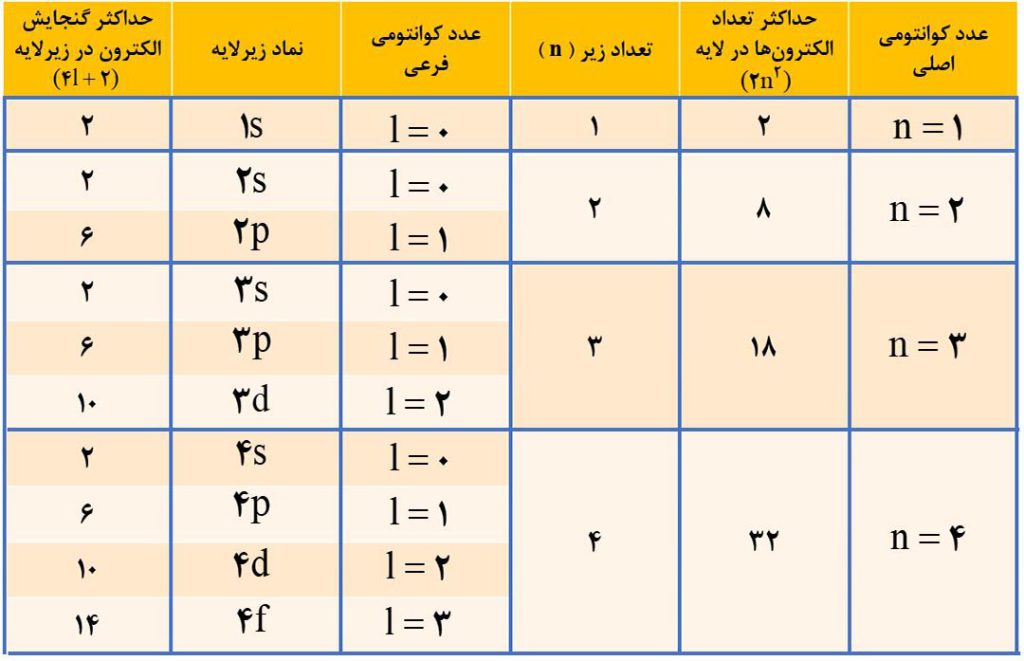
براساس مدل کوانتومی، اتم را می توان مانند کره ای در نظر گرفت که هستۀ بسیار کوچک و سنگینی در مرکز آن جای دارد که محل تمرکز پروتون ها و نوترون ها است. پیرامون هسته، الکترون ها در لایه های الکترونی حضور دارند. برای مشخص کردن لایه های الکترونی از عدد کوانتومی اصلی ( n ) استفاده می شود.
حداکثر گنجایش الکترونی یک لایۀ الکترونی برابر با 2n2 است. به این ترتیب در لایۀ اول ( n=1 )، 2 الکترون، در لایۀ دوم ( n=2 )، 8 الکترون، در لایۀ سوم ( n=3 )، 18 الکترون، در لایۀ چهارم ( n=4 )، 32 الکترون و … قرار می گیرد.
هر لایۀ الکترونی از بخش های کوچکتری به نام زیرلایه تشکیل شده است. هر لایه با عدد کوانتومی اصلی n، دارای n زیرلایه است. به طور مثال لایۀ اول دارای 1 زیر لایه، لایۀ دوم دارای 2 زیر لایه و لایۀ سوم دارا 3 زیر لایه و … است.
توجه: لایۀ اول برخلاف دیگر لایه های الکترونی، یکپارچه است؛ زیرا فقط دارای یک زیرلایه است.
در مدل کوانتومی اتم، به هر نوع زیرلایه یک عدد کوانتومی نسبت می دهند. این عدد کوانتومی با نماد l نشان داده شده و عدد کوانتومی فرعی نامیده می شود. مقادیر معین و مجاز l، اعدادی بین صفر تا ( n-1 ) می تواند باشد. به طور مثال در لایۀ چهارم ( n=4 )، l میتواند 0 و 1 و 2 و 3 باشد.
مقادیر عددی l را معمولاً با حروف هم نشان می دهند؛ به طور مثال l=0 را با s نمایش، l=1 را با p نمایش، l=2 را با d نمایش و l=3 را با f نمایش می دهند.
حداکثر گنجایش الکترونی یک زیرلایه برابر 4l+2 است.

نماد هر زیرلایۀ معین با دو عدد کوانتومی n و l مشخص می شود. به همین خاطر زیرلایه ها را می توان با نماد nl نشان داد که در آن l را با حروف f, d, s, p نشان می دهند. به طور مثال نماد 3d زیر لایه ای در لایۀ سوم و با l=2 را نشان میدهد.
همانطور که گفتیم مقادیر معین و مجاز l در یک لایۀ الکترونی، اعداد بین صفر تا ( n-1 ) می تواند باشد؛ یعنی در یک زیر لایه با نماد nl، همواره n>1 است؛ بنابراین هیچ لایه ای وجود ندارد که دو عدد کوانتومی اصلی و فرعی آن یکسان باشد. به طور مثال زیرلایۀ 3f ( l=3 و n=3 ) وجود خارجی ندارد.
جمع بندی:
21- قاعدۀ آفبا
ترتیب پر شدن زیرلایه های یک اتم، با قاعدۀ آفبا بیان می شود. آفبا واژه ای آلمانی به معنای ساختن یا افزایش گام به گام است. برطبق این قاعده الکترون ها تمایل دارند، ابتدا زیرلایه هایی را پر کنند که انرژی کمتری دارند.
انرژی زیرلایه ها به مجموع عدد کوانتومی اصلی و فرعی ( n+l ) وابسته است.
نکته: هرچه مقدار ( n+l ) برای زیرلایه ای کوچکتر باشد، این زیرلایه، انرژی کمتری دارد و زودتر از الکترون پر می شود.
توجه: اگر ( n+l ) برای دو زیرلایه یکسان باشد، زیرلایه ای که n آن کوچکتر است، انرژی کمتری دارد و زودتر از الکترون پر می شود.
ویدئوی آموزشی قاعدۀ آفبا ( شیمی 1 پایۀ دهم فصل یک )
در این ویدئو، با طرز پر شدن زیر لایه ها به کمک قاعدۀ آفبا، آشنا می شوید.
22- آرایش الکترونی گسترده و فشرده
به توزیع الکترون ها در زیر لایه های الکترونی اطراف هستۀ اتم ها، آرایش الکترونی می گویند. برای نوشتن آرایش الکترونی یک اتم، باید زیرلایه ها را براساس قاعدۀ آفبا از الکترون پُر کنیم تا جایی که مجموع تعداد الکترون زیر لایه ها با تعداد الکترون های اتم موردنظر برابر شود.
یادآوری: تعداد الکترون ها در هر زیرلایه به صورت توان و بعد از نماد زیرلایه قرار می گیرد.
آموزش ویدئویی آرایش الکترونی گسترده و فشرده
23- الکترون های ظرفیت
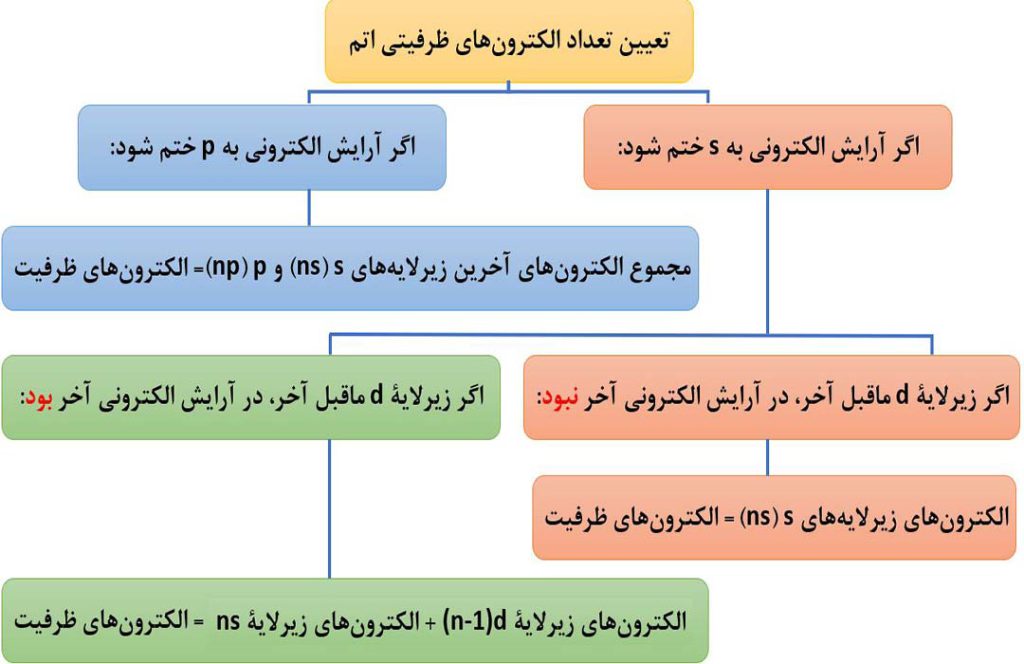
لایۀ ظرفیت یک اتم، لایه ای است که الکترون های آن، رفتار شیمیایی اتم را تعیین می کنند. به الکترون های لایۀ ظرفیت، الکترون های ظرفیت اتم می گویند. برای تعیین الکترون های ظرفیتی به صورت زیر عمل می کنیم:
توجه: بهتر است برای تعیین الکترون های ظرفیت یک اتم، از آرایش فشردۀ آنها استفاده شود.

نکات مهم تعیین الکترون های ظرفیتی
نکتۀ1) در آرایش الکترونی فشرده، لزوماً هر چیزی که بعد از نماد گاز نجیب نوشته می شود، جزء لایۀ ظرفیت نیست. به طور مثال در مثال 4 عکس 50 در آرایش فشردۀ Br، بعد از نماد گاز نجیب Ar، زیرلایۀ 3d هم وجود دارد که جزء لایۀ ظرفیت به شمار نمی آید.
توجه: این اتفاق در جدول تناوبی برای عناصر با عدد اتمی بزرگتر از 30 ( بعد از اتم Zn = زینک = روی )، رخ می دهد.
نکتۀ2) همواره بیرونی ترین لایۀ اتم همۀ عناصر، لایۀ ظرفیت اتم نیست. در عنصرهایی که آخرین الکنرون آنها وارد زیرلایۀ d می شود ( مانند مثال 2 از عکس 50 )، الکترون های ظرفیت در دو لایۀ متفاوت n و (n-1) قرار دارند.
برای این عنصرها به جای عبارت ” لایۀ ظرفیت ” از عبارت ” الکترون های ظرفیت ” استفاده می شود.
تنها در حالتی لایۀ ظرفیت، بیرونی ترین لایۀ الکترونی است که آخرین الکترون وارد زیرلایۀ s یا p شود.
24- تعیین موقعیت عنصرها در جدول تناوبی
برای تعیین شمارۀ دوره ( تناوب = ردیف = n ) و گروه ( خانواده = ستون ) در جدول دوره ای به کمک آرایش الکترونی، به صورت زیر عمل می کنیم:
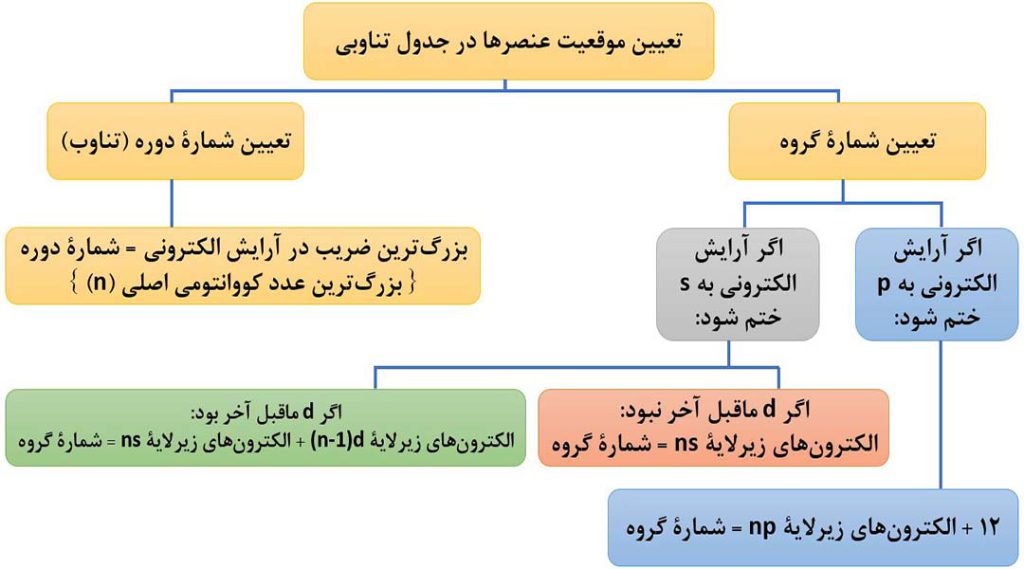
توجه: الگوریتم بالا برای تعیین گروه عنصر هلیم ( 2He )، جواب نمی دهد!
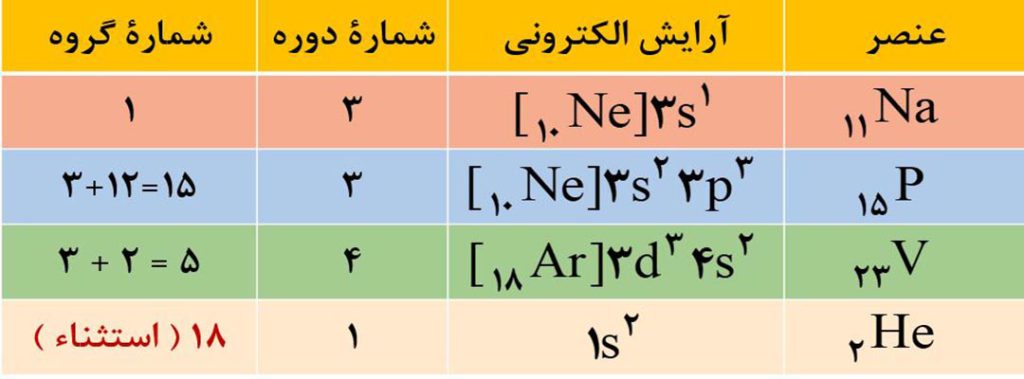
تعیین موقعیت عناصر با استفاده از عدد اتمی گازهای نجیب
آ) تعیین شمارۀ دوره: گازهای نجیب با عددهای اتمی گازهای نجیب هم می توانیم شمارۀ دوره و گروه عنصرها را تعیین کنیم.
برای تعیین شمارۀ دورۀ یک عنصر کافی است عدد اتمی عنصر مورد نظر را بین عدد اتمی دو گاز نجیب قبلی و بعدی آن قرار دهیم. شمارۀ دورۀ عنصر با شمارۀ دورۀ گاز نجیب بعدی یکسان است.
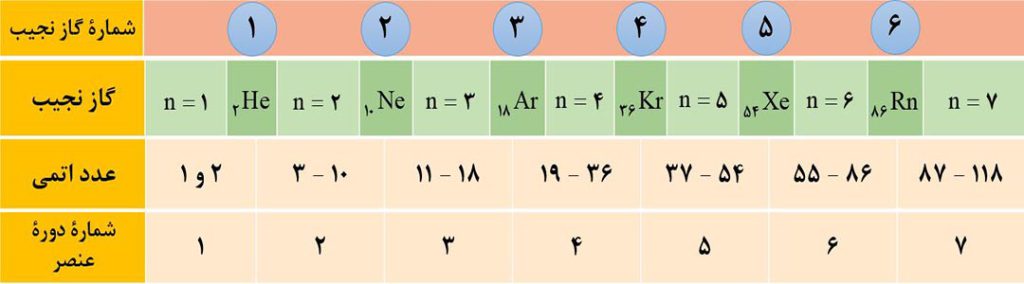
ب) تعیین شمارۀ گروه: برای تعیین شمارۀ گروه، سه حالت پیش می آید:
حالت1) اگر عدد اتمی عنصر موردنظر، یک یا دو واحد بیشتر از عدد اتمی یکی از گازهای نجیب باشد، در این حالت شمارۀ گروه برابر با تفاوت عدد اتمی عنصر با گاز نجیب دورۀ قبل است. ( شمارۀ گروه برابر 1 یا 2 می باشد. ).
مثال: عنصری با عدد اتمی 19 متعلق به گروه اول است ( چون 1=18-19 ) و عنصری با عدد اتمی 56 متعلق به گروه 2 است ( چون 2=54-56 ).
حالت2) عنصرهایی که در دو رودیف پایین جدوا تناوبی قرار دارند ( لانتانیدها با عدد اتمی 57 تا 70 و آکتنیدها با عدد اتمی 89 تا 102 ) همگی به گروه 3 تعلق دارند.
حالت3) برای بقیۀ عنصرها که عدد اتمی آنها بیش از دو واحد از عدد اتمی گاز نجیب قبل از خود بیشتر است، باید اختلاف عدد اتمی عنصر و گاز نجیب هم دوره اش را از عدد 18 کم کنیم تا شمارۀ گروه بدست آید.
فیلم آموزشی تعیین موقعیت عناصر به کمک گاز نجیب
همانطور که می دانید، شمارۀ بیرونی ترین لایه در همۀ عنصرهای یک دوره، یکسان است؛ به عبارت دیگر تعداد لایه های الکترونی اشغال شده در عنصرهای یک دوره؛ برابر است؛ به طور مثال همۀ عنصرهای دورۀ چهارم، دارای 4 لایۀ الکترونی هستند ( بزرگترین ضریب در آرایش الکترونی آنها 4 است).
در عنصرهای یک گروه، تعداد لایه های الکترونی اشغال شده متفاوت است، اما همۀ آنها تعداد الکترون های ظرفیت یکسانی دارند ( البته به جز هلیم که در گروه 18 است. ).
به طور مثال همۀ عنصرهای گروه 16 دارای 6 الکترون ظرفیت هستند.

25- دسته بندی عنصرها به s، p، d، f
عنصرهای موجود در جدول دوره ای را می توان براساس زیرلایه های در حال پر شدن آنها، به چهار دسته تقسیم بندی کرد.
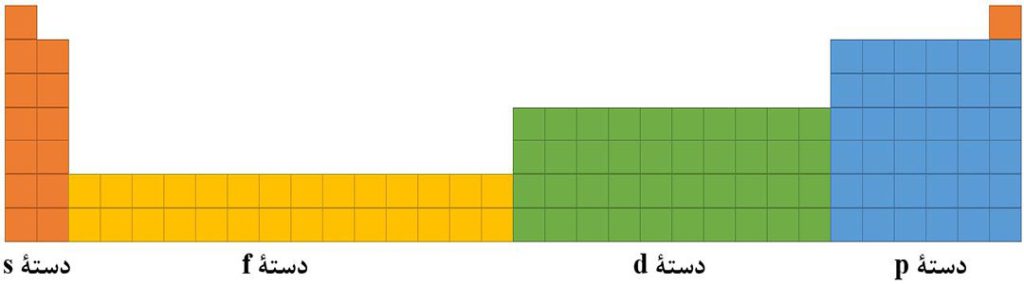
1) عناصر دستۀ s: به عناصری که زیرلایۀ s آنها در حال پرشدن است، عناصر دستۀ s می گویند.
2) عناصر دستۀ p: به عناصری که زیرلایۀ p آنها در حال پرشدن است، عناصر دستۀ p می گویند.
3) عناصر دستۀ d: به عناصری که زیرلایۀ d آنها در حال پرشدن است، عناصر دستۀ d می گویند.
4) عناصر دستۀ f: به عناصری که زیرلایۀ f آنها در حال پرشدن است، عناصر دستۀ f می گویند.
نکات مهم دسته ها در جدول تناوبی
حتما این نکات را به خاطر بسپارید.
نکتۀ1) آمار گلی از دسته ها:
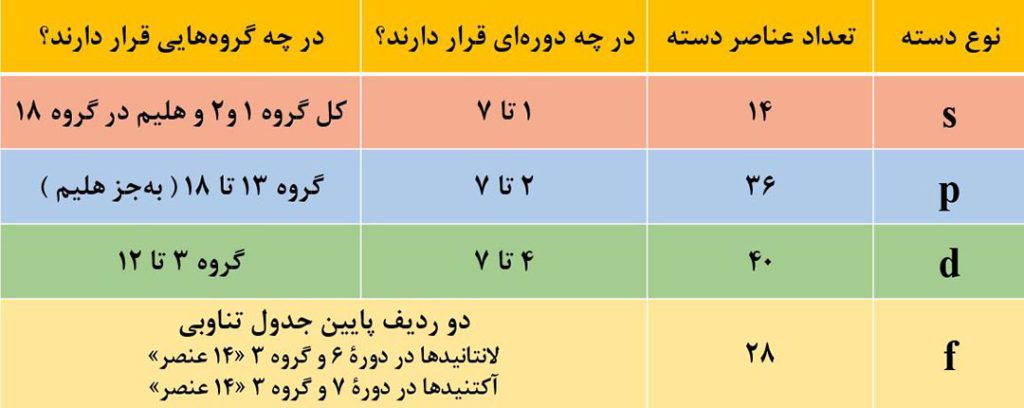
نکتۀ2) تعداد ستون های هر دسته از عناصر در جدول دوره ای با حداکثر گنجایش الکترونی زیرلایۀ مربوطه برابر است. در واقع عنصرهای دستۀ s دارای 2 ستون، عنصرهای دستۀ p دارای 6 ستون، عنصرهای دستۀ d دارای 10 ستون و عنصرهای دستۀ f دارای 14 ستون در جدول دوره ای هستند.
نکتۀ3) در عنصرهای دستۀ s و d ( به جز هلیم ) شمارۀ گروه با تعداد الکترون های ظرفیتی برابر است، اما در عنصرهای دستۀ p، شمارۀ گروه از تعداد الکترون های ظرفیت، 10 واحد بیشتر است. ( توجه شود به دستۀ fها کاری نداریم! )
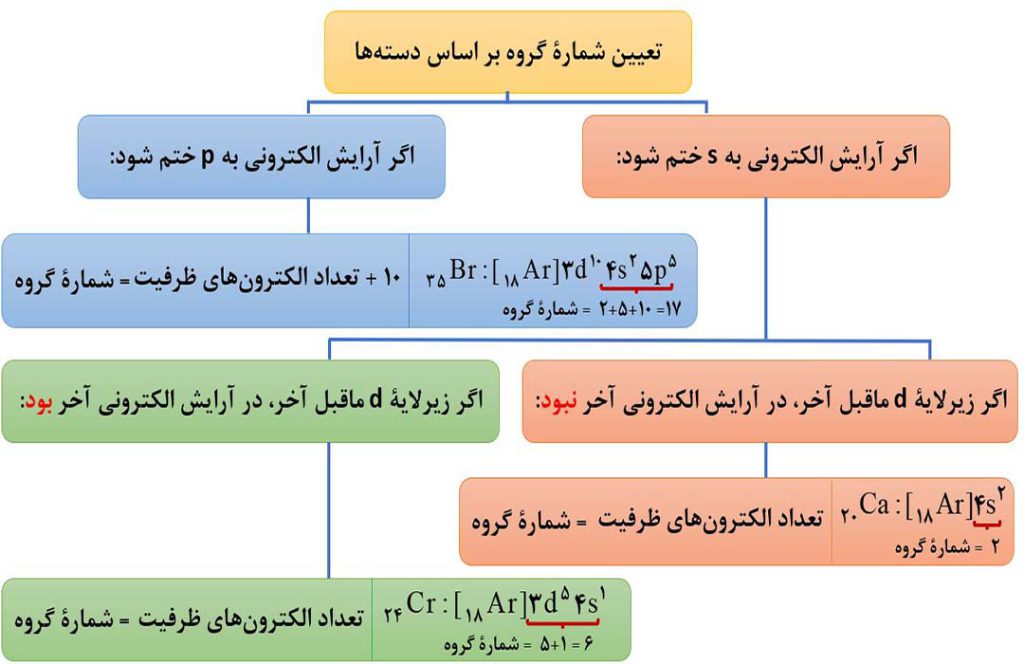
توجه: هلیم ( 2He ) جزء عنصرهای دستۀ s بوده و دارای دو الکترون ظرفیتی است؛ اما شمارۀ گروه آن برابر 18 است ( هلیم در الگوریتم بالا استثناء می باشد. ).
مقالات مرتبط فصل1 شیمی1
فصل1 – بخش صفر – اهمیت شیمی در کنکور سراسری
فصل1 – بخش اول – تبدیل واحدها – رابطۀ انیشتین
فصل1 – بخش دوم – ذرات زیر اتمی – ایزوتوپ ها
فصل1 – بخش سوم – جرم اتمی میانگین – آشنایی با جدول تناوبی
فصل1 – بخش چهارم – مول چیست؟ – آموزش استوکیومتری
فصل1 – بخش پنجم – نور کلید شناخت جهان هستی – طیف نشری هیدروژن




















یک پاسخ
بسیار عالی و کامل.🌹❤️