این بخش شامل قسمت های زیر است:
16- نور، کلید شناخت جهان
17- طیف نشری خطی عنصرها
18- کشف ساختار اتم
19- طیف نشری خطی هیدروژن
16- نور، کلید شناخت جهان
| دانلود جزوه تمامی فرمول های شیمی |
از آنجایی که خورشید و دیگر اجرام آسمانی از ما بسیار دور هستند، ویژگی های آنها را نمی توان به طور مستقیم اندازه گیری کرد. همچنین دمای بسیار داغ را نمی توان با ابزاری مانند دماسنج تعیین کرد؛ زیرا دماسنج ها در دماهای بالا ذوب می شوند. اینجاست که نور می تواند به کمک ما بیایید. نوری که از ستاره یا سیاره ای به ما می رسد، نشان می دهد که آن ستاره یا سیاره از چه ساخته شده یا دمای آن چقدر است.
دانشمندان با استفاده از دستگاهی به نام طیف سنج می توانند از نورهای نشر شده از مواد گوناگون، اطلاعات ارزشمندی به دست آورند.
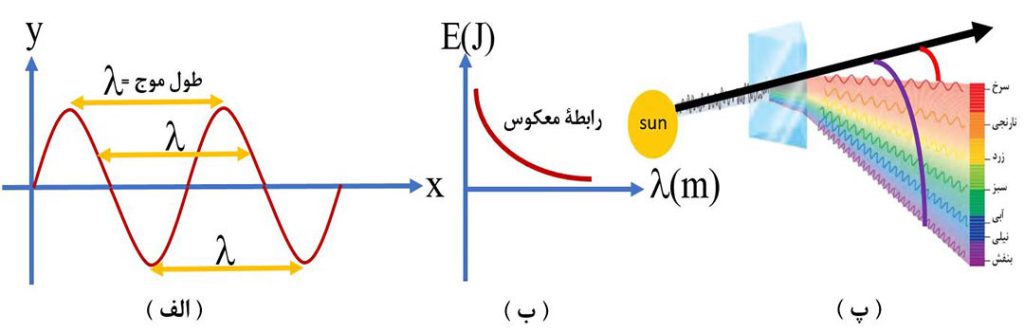
نور، شکلی از انرژی است که به صورت موج منتشر می شود. یکی از ویژگی های موج، طول موج است. به فاصلۀ دو قله یا دو درۀ متوالی ( به طور کلی دو نقطه مشابه از نظر مکان و شیب )، طول موج می گویند.
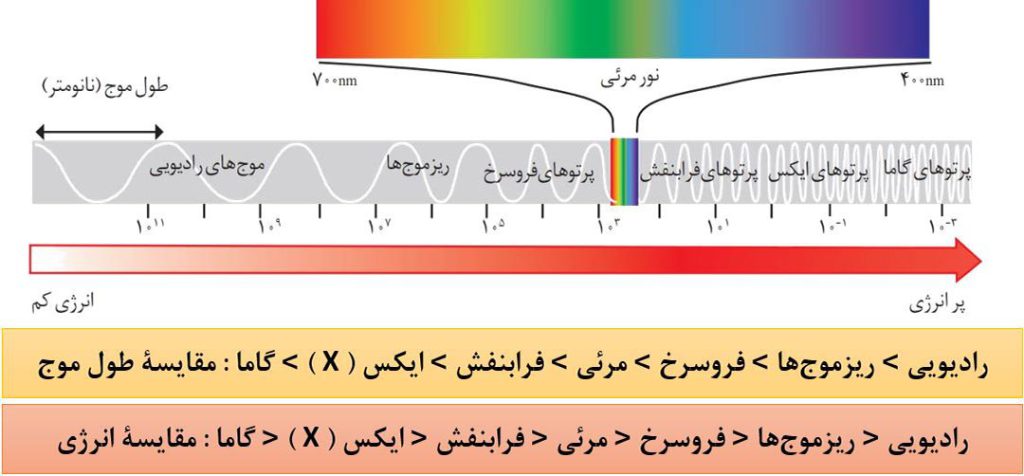
طول موج یک پرتو با انرژی آن، رابطۀ وارونه دارد. یعنی هر چه طول موج یک پرتو کوتاه تر باشد، انرژی آن پرتو بیشتر است ( انرژی بیشتری با خود حمل می کند).
نور خورشید با عبور از قطره های آب موجود در هوا یا هنگام عبور از منشور، تجزیه شده و گستره ای پیوسته از رنگ ها را ایجاد می کند. این گسترۀ رنگی شامل بی نهایت طول موج از رنگ های گوناگون است، اما چشم ما تنها می تواند گسترۀ محدودی از نور خورشید را ببیند که به آن گسترۀ مرئی می گویند.
بین میزان ( زاویه ) شکست و انحراف یک پرتو مرئی در عبور از منشور با طول موج آن، رابطۀ عکس ( وارون ) وجود دارد. به طوری که هر چه طول موج تابیده شده به منشور کوتاه تر باشد( یا انرژی آن بیشتر باشد)، میزان شکست آن هنگام عبور از منشور بیشتر است.

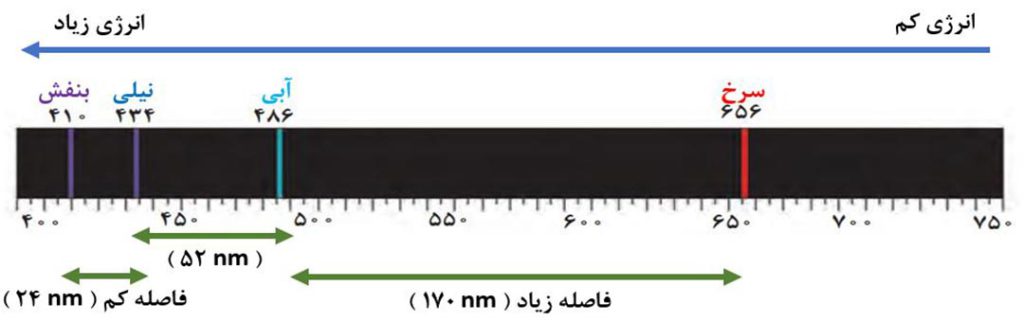
نور مرئی فقط بخش کوچکی از گسترۀ پرتوهای الکترومغناطیس است. همانطور که در شکل می بینید، نور مرئی گسترۀ محدودی با طول موج 400 نانومتر ( بنفش ) تا 700 نانومتر ( قرمز ) را شامل می شود.
17- طیف نشری خطی عنصرها
تجربه نشان می دهد که بسیاری از نمک ها، شعلۀ رنگی دارند و اگر مقداری از محلول آنها را روی شعله بپاشیم، رنگ شعله تغییر می کند. رنگ شعلۀ فلزها با رنگ شعلۀ ترکیب های دارای این فلزها، مشابه است.
شعلۀ ترکیب های هر فلز، رنگ منحصر به فردی دارد و رنگ نشر شده فقط باریکۀ بسیار کوتاهی از گسترۀ طیف مرئی را در بر می گیرد؛ بنابراین از روی تغییر رنگ شعله می توان به وجود عنصر فلزی در آن پی برد.

همانطور که دیدید رنگ شعلۀ سدیم، زرد می باشد. نور زرد لامپ هایی که شب هنگام خیابان ها را روشن می سازد، به دلیل وجود بخار سدیم در این لامپ ها است.
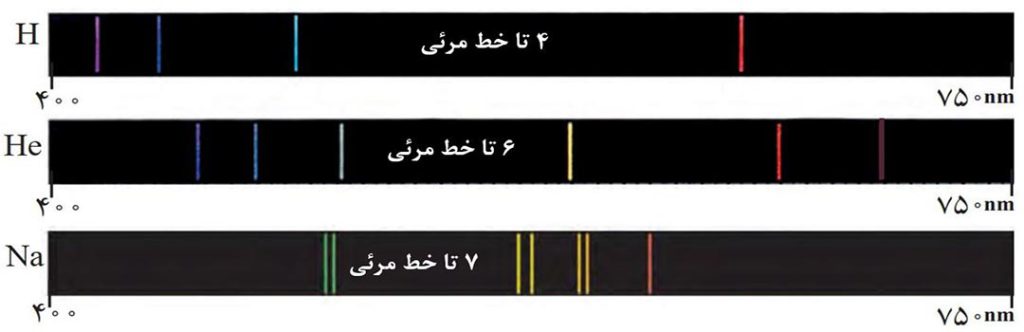
شیمیدان ها به فرایندی که در آن یک مادۀ شیمیایی با جذب انرژی، از خود پرتوهای الکترومغناطیس گسیل می دارد، نشر می گویند. اگر نور نشر شده از یک عنصر یا ترکیب دارای آن عنصر را از منشور عبور دهیم، الگویی شامل خطها یا نوارهای مجزای رنگی به وجود می آید که به آن طیف نشری خطی می گویند.
مثال: شکل زیر طیف نشری خطی لیتیم را نشان می دهد. همانطور که می بینید طیف نشری خطی این عنصر در گسترۀ مرئی، تنها شامل 4 خط با طول موج رنگی است.

هر عنصر ( چه فلز و چه نافلز )، طیف نشری خطی ویژۀ خود را دارد و تعداد خطوط، محل قرارگیری و طول موج آنها برای آن عنصر کاملا اختصاصی است؛ بنابراین مانند اثر انگشت می توان از این طیف برای شناسایی آن عنصر استفاده کرد.
توجه: از لامپ نئون در ساخت تابلوهای تبلیغاتی برای ایجاد نوشته های نورانی سرخ رنگ ( سرخ فام ) استفاده می شود.
18- کشف ساختار اتم
همانطور که می دانید، هر نوار رنگی در طیف نشری خطی، نوری با طول موج و انرژی معین را نشان می دهد. نیلز بور با بررسی تعداد و جایگاه خطوط در طیف نشری خطی هیدروژن و در نظر گرفتن اینکه الکترون در اتم هیدروژن انرژی معینی دارد، مدلی برای اتم هیدروژن ارائه کرد. مدل بور به مدل منظومۀ شمسی معروف است. در این مدل، الکترون ها در مسیرهای دایره ای به نام مدار به دور هسته در حال چرخش هستند.
توجه: مدل بور با موفقیت توانست طیف نشری خطی هیدروژن را توجیه کند؛ اما توانایی توجیه طیف نشری خطی دیگر عنصرها را نداشت.
دانشمندان به دنبال توجیه و علت ایجاد طیف نشری خطی دیگر عنصرها و نیز چگونگی نشر نور از اتم ها، ساختاری لایه ای برای اتم ارائه کردند.

در ساختار لایه ای اتم، هر بخش پررنگ، مهمترین بخش از یک لایۀ الکترونی است؛ بخشی که الکترون های آن لایه، بیشتر وقت خود را در آن فاصله از هسته سپری می کنند. پس مواظب باشید، الکترون در هر لایه ای که باشد، در همۀ نقاط اطراف هسته حضور دارد، اما در محدودۀ پررنگ، احتمال حضور آن بیشتر است.
6 نکته در مورد ساختار لایه ای اتم
1) در ساختار لایه ای، لایه ها را از هسته به سمت بیرون شماره گذاری میکنند و شمارۀ هر لایه را با n نشان می دهند. n عدد کوانتومی اصلی نامیده می شود. به این ترتیب برای لایۀ اول ( نزدیک ترین لایه به هسته ) n=1، برای لایۀ دوم n=2 و …. است.
2) انرژی الکترون های موجود در اتم با شمارۀ لایه ها رابطۀ مستقیم دارد؛ یعنی هرچه الکترون در لایۀ دورتری از هسته باشد، انرژی آن بیشتر است.
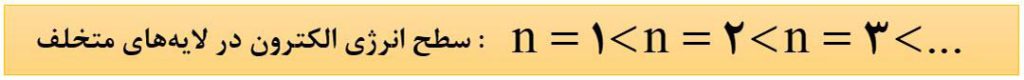
3) یک الکترون در اتم به هیچ وجه نمی تواند هر مقدار انرژی را داشته باشد و مقادیر انرژی آن تنها می تواند مقدارهای معینی باشد. در واقع انرژی الکترون ها در لایه ها، کوانتومی ( گسسته ) است.
توجه: به طور کلی دو کمیت وجود دارد: 1) کمیت های پیوسته که مقدارشان هر عددی می تواند باشد؛ مانند مساحت یک قطعه زمین که می تواند 1400، 2021/3 و یا هر عدد غیرمنفی باشد. 2) کمیت های گسسته ( کوانتومی ) که مقدارشان تنها می تواند عددهای معینی باشد؛ مانند تعداد دانش آموزان یک کلاس که می تواند 15 یا 25 نفر باشد ولی نمیتواند 22/5 نفر باشد!
4) الکترون ها در اتم، معمولاً در پایین ترین و پایدارترین لایه های ممکن قرار می گیرند؛ به طوری که گفته می شود اتم در حالت پایه قرار دارد. اگر به اتم های گازی یک عنصر به مقدار کافی و معین انرژی داده شود، الکترون ها با جذب انرژی از حالت پایه به لایه های بالاتر منتقل می شوند. به اتم ها در چنین حالتی، اتم های برانگیخته می گویند.
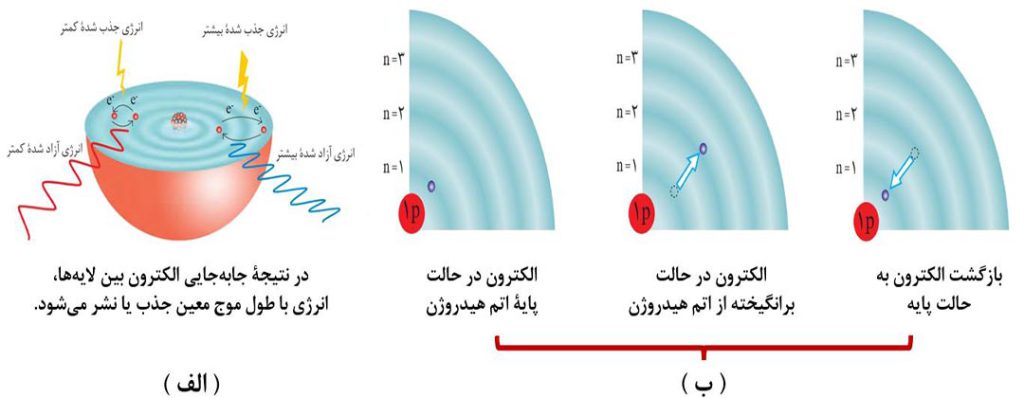
توجه: هرچه مقدار انرژی جذب شده بیشتر باشد، الکترون ها به لایه های بالاتری منتقل می شوند. همانطور که در شکل بالا ( الف ) مشاهده می کنید، انرژی مورد نیاز برای انتقال الکترون از n=2 به n=4 بیشتر از انرژی لازم برای انتقال الکترون از n=2 به n=3 است.
توجه: اتم هیدروژن دارای یک الکترون بوده و حالت پایۀ اتم هیدروژن همان لایۀ اول ( n=1 ) است. مطابق تصویر بالا قسمت ( ب )، با دادن انرژی به اتم هیدروژن می توان این الکترون را برانگیخته ( n>1 ) کرد.
در مدل لایه ای، دادوستد انرژی، هنگام انتقال الکترون از یک لایه به لایۀ دیگر، کوانتومی است. در واقع الکترون هنگام انتقال از یک لایه به لایۀ دیگر، انرژی را به صورت پیمانۀ معینی، جذب یا نشر می کند؛ به همین دلیل چنین ساختار لایه ای را برای اتم، مدل کوانتومی اتم نیز می نامند.
5) اتم های برانگیخته، پرانرژی تر و ناپایدارتر از حالت پایه هستند؛ به همین دلیل دوست دارند با از دست دادن مقدار معینی انرژی به حالت پایدارتر و درنهایت به حالت پایه بازگردند.
توجه: برای الکترون، نشر نور مناسب ترین شیوه برای از دست دادن انرژی است؛ به همین دلیل الکترون های برانگیخته، به هنگام بازگشت به حالت پایه، انرژی اضافی خود را که همان تفاوت انرژی میان دو لایه است، از طریق انتشار نور با طول موج معین از دست می دهند.
توجه: هر خط یا نوار رنگی در طیف نشری خطی هر عنصر، پرتوهای نشر شده هنگام بازگشت الکترون از لایه های بالاتر ( در حالت برانگیخته ) به لایه های پایین تر را نشان می دهد.
نکتۀ مهم: از آنجا که انرژی لایه های الکترونی اطراف هستۀ هر اتم، ویژۀ همان اتم بوده و به عدد اتمی آن وابسته است، انرژی لایه ها و تفاوت انرژی میان آنها در اتم عنصرهای گوناگون متفاوت می باشد؛ در نتیجه هر عنصر طیف نشری خطی مخصوص به خود را دارد.
6) هرگاه یک جریان الکتریکی متناوب ( ac ) 110 ولتی به یک خیارشور اعمال شود، خیارشور به رنگ زرد شروع به درخشیدن می کند. دلیل این موضوع بازگشت الکترون های برانگیختۀ اتم سدیم موجود در خیارشور به حالت پایه و نشر نور می باشد.
19- طیف نشری خطی هیدروژن
در گسترۀ مرئی طیف نشری خطی به دست آمده از اتم های هیدروژن، چهار خط یا نوار رنگی وجود دارد. این خطوط مربوط به انتقال الکترون از لایه های بالاتر ( n=3,4,5,6 ) به لایۀ دوم ( n=2 )هستند. ویژگی ها و چگونگی تشکیل این خطوط به شرح زیر است.

نکتۀ1) هرچه به هستۀ اتم نزدیک تر شویم، تفاوت انرژی بین دو لایۀ متوالی افزایش می یابد. به طور مثال تفاوت انرژی بین لایۀ 1 و 2 بیشتر از تفاوت انرژی بین بین لایۀ 2 و 3 است. می دانیم که انرژی با طول موج رابطۀ وارونه دارد؛ بنابراین می توان چنین نوشت.

سؤال: موج حاصل از انتقال الکترون از ( n=4 به n=3 ) و ( n=3 به n=1 ) در اتم هیدروژن، در چه ناحیه ای قرار می گیرند؟ ( فروسرخ، مرئی یا فربنفش ) طول موج و انرژی آن دو را با هم مقایسه کنید. دلیل خود را کامل شرح دهید.
نکتۀ2) در طیف نشری خطی هیدروژن، با افزایش طول موج پرتو نشر شده، تفاوت طول موج دو نوار رنگی مجاور هم بیشتر می شود یا می توان گفت در طیف نشری خطی هیدروژن هرچه به سمت خطوط پرانرژی می رویم، فاصلۀ بین خطوط کمتر می شود.
آموزش ویدئویی طیف نشری خطی هیدروژن
در این ویدئو، با طیف نشری خطی اتم هیدروژن آشنا شده و همچنین در انتهای آن تمرین های جلسات قبل نیز حل می شود.
مقالات مرتبط فصل1 شیمی1
فصل1 – بخش صفر – اهمیت شیمی در کنکور سراسری
فصل1 – بخش اول – تبدیل واحدها – رابطۀ انیشتین
فصل1 – بخش دوم – ذرات زیر اتمی – ایزوتوپ ها
فصل1 – بخش سوم – جرم اتمی میانگین – آشنایی با جدول تناوبی
فصل1 – بخش چهارم – مول چیست؟ – آموزش استوکیومتری




















5 پاسخ
بسیار عالی و کامل.❤️🌹
واقعا درست گفتی آقای اکبرپور ممنون استاد نجفی
Perfect
خداقوت ممنون بسیار کامل و جامع🙏🌹
عالی