بخش 1 فصل 1 آموزش خط به خط شیمی یازدهم شامل موارد زیر می باشد:
- اهمیت مواد در زندگی
- چرخۀ مواد در طبیعت
- فلزها، نافلزها و شبه فلزها
- روند تغییر خصلت فلزی و نافلزی در جدول دوره ای
- آشنایی یا عناصر گروه 14 و دورۀ سوم جدول تناوبی
1- اهمیت مواد در زندگی
| دانلود جزوه تمامی فرمول های شیمی |
رشد و گسترش تمدن بشری را می توان در گرو کشف و شناخت مواد جدید دانست. انسان های پیشین فقط از برخی مواد طبیعی مانند چوب، سنگ، خاک، پشم و پوست استفاده می کردند، اما با گذشت زمان توانستند موادی مانند سفال را تولید و برخی فلزها را نیز استخراج کنند که خواص مناسب تری داشتند.
با گسترش دانش تجربی، شیمی دان ها به رابطۀ میان خواص مواد با عنصرهای سازندۀ آنها پی بردند. آنها فهمیدند که گرما دادن به مواد و افزودن آنها به یکدیگر سبب تغییر و گاهی بهبود خواص می شود. آنها آرام آرام به توانایی انتخاب مناسب ترین ماده برای کاربرد معین دست یافتند.
گسترش فناوری به میزان دسترسی به مواد مناسب وابسته است؛ به طوری که کشف و درک خواص یک مادۀ جدید، باعث توسعۀ فناوری می شود. به طور مثال گسترش صنعت خودرو، مدیون شناخت و دسترسی به فولاد است. پیشرفت صنعت الکترونیک هم به اجزایی وابسته است که از موادی به نام نیمه رسانا ساخته می شود.
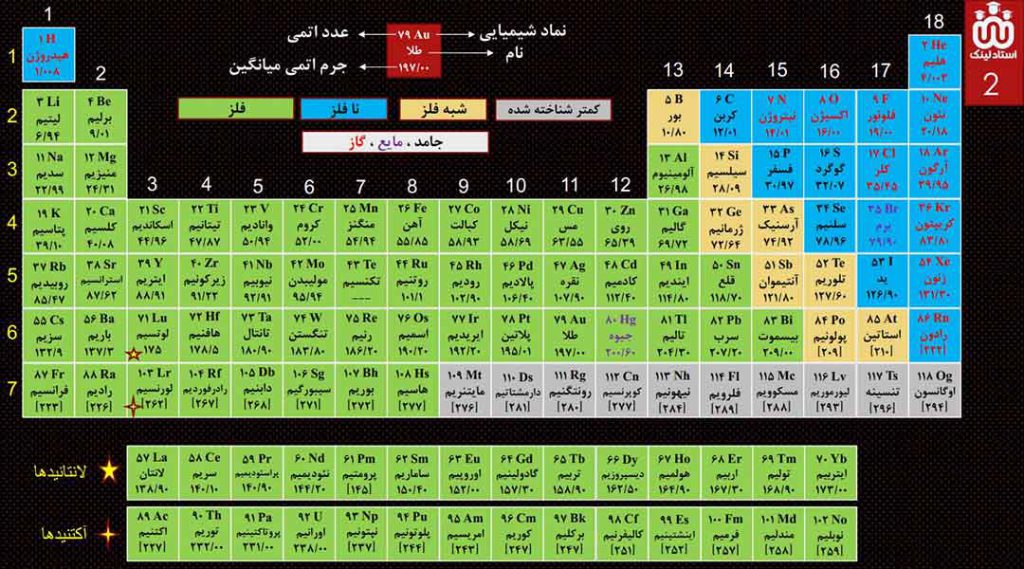
زمین منبع عظیمی از هدایای ارزشمند و ضروری برای زندگی است. سالانه منابع شیمیایی زیادی از زمین استخراج می شود. نمودار زیر، میزان تولید یا مصرف نسبی برخی مواد را در جهان نشان می دهد.
چند نتیجه:
1- با پیشرفت صنعت، سطح رفاه در جامعه بالا رفته و به همین دلیل میزان مصرف منابع گوناگون افزایش یافته است.
2- مقایسۀ مقادیر استخراج سالانۀ مواد از کرۀ زمین به صورت زیر است:
فلزها < سوخت های فسیلی < مواد معدنی
3- در سال 2030 به تقریب، 70 میلیارد تن از مواد معدنی، فلزها و سوخت های فسیلی از زمین استخراج خواهد شد.
4- با توجه به نمودار بالا می توان میزان استخراج هر یک از منابع را کشف کرد. به طور مثال در سال 2015 به تقریب 7 میلیارد تن فلز در جهان استخراج و مصرف شده است.
5- هر چند زمین، انباری از ذخایر ارزشمند است، اما این منابع به طور یکسان توزیع نشده است؛ به خاظر همین پراکندگی منابع، تجارت جهانی به وجود آمده است.
6- لزوماً هر چه میزان بهره برداری از منابع یک کشور بیشتر باشد، آن کشور توسعه یافته تر نیست؛ بهره برداری از منابع، باید اصولی و مطابق با توسعۀ پایدار باشد.
2- چرخۀ مواد در طبیعت | آموزش خط به خط شیمی یازدهم

همانطور که می دانید مواد را می توان به دو دستۀ طبیعی و ساختگی تقسیم کرد. مواد طبیعی موادی هستند که به طور مستقیم و بدون تغییر از کرۀ زمین به دست می آیند؛ مانند نفت خام، اکسیژن، ماسه و …
مواد ساختگی به شکلی که امروزه وجود دارند و ما از آنها استفاده می کنیم، در طبیعت وجود ندارند. انسان مواد ساختگی را از مواد طبیعی می سازد؛ مانند پلاستیک ها، فلز آهن و …!
هر ساله مقدار زیادی از مواد از کرۀ زمین استخراج می شوند. در مراحل بعدی این مواد فراوری شده و از آنها، فلز، مواد شیمیایی و … به دست می آید. از این مواد هم برای تولید لوازم و ابزارهای مختلفی مانند خودرو، لوازم خانه، وسایل الکترونیکی و … استفاده می شود.
پس می توان گفت همۀ مواد طبیعی و ساختگی از کرۀ زمین به دست می آیند.
نتیجه: موادی که از طبیعت به دست می آیند به شکل ضایعات و پسماند، دوباره به طبیعت باز می گردند؛ بنابراین می توان گفت به تقریب، جرم مواد در کرۀ زمین ثابت می ماند.
3- فلزها، نافلزها و شبه فلزها
شیمی دان ها به منظور یافتن اطلاعات بیشتر و دقیق تر دربارۀ ویژگی ها و خواص مواد، با مشاهدۀ آنها و انجام آزمایش های گوناگون، مواد را دقیق بررسی می کنند، اما برقراری ارتباط میان این داده ها و اطلاعات و همینطور یافتن الگوها و روندها، گامی مهم تر و مؤثرتر در پیشرفت علم شیمی به حساب می آید؛ چون براساس این روندها ، الگوها و روابط می توان فهمید در دنیا چه خبر است.
به همین دلیل علم شیمی را می توان مطالعۀ هدفدار، منظم و هوشمندانۀ رفتار عنصرها و مواد برای پیدا کردن روندها و الگوهای رفتار فیزیکی و شیمیایی آنها دانست.
در سال دهم با جدول دوره ای عنصرها آشنا شدیم و خواندیم که عنصرها در این جدول براساس بنیادی ترین ویژگی آنها یعنی عدد اتمی (Z) چیده شده اند. این جدول به شیمی دان ها کمک می کند که حجم وسیعی از مشاهده های خود را سازماندهی و تجزیه و تحلیل کنند تا الگوهای پنهان در رفتار عنصرها را آشکار نمایند.
بررسی ها نشان می دهد که عنصرهای جدول تناوبی را براساس رفتار آنها می توان به سه دستۀ فلز، نافلز و شبه فلز قرار داد. در ادامه خواص هر یک از این دسته ها را بررسی می کنیم:
1- ویژگی فلزها | شیمی یازدهم

چند نکته در مورد فلزها
- همۀ فلزها ویژگی های بالا را ندارند. به طور مثال فلزهای گروه اول نه تنها سختی و استحکام بالایی ندارند، بلکه آنچنان نرم اند که با چاثو بریده می شوند.
- بیشتر عنصرهای جدول دوره ای را فلزها تشکیل می دهند که به طور عمده در سمت چپ و مرکز جدول قرار دارند.
- فلزها در هر چهار دستۀ d ,p ,s و f قرار دارند. فلزهای دستۀ s مانند فلزهای گروه اول و دوم، فلزهای دستۀ p مانند آلومینیوم (Al)، قلع (Sn)، و سرب (Pb)، فلزهای دستۀ d مانند آهن (Fe) و مس (Cu) و فلزهای دستۀ f مانند اورانیوم (U).
2- ویژگی نافلزها

ویژگی نافلزها | آموزش خط به خط شیمی یازدهم
- نافلزها به طور عمده در سمت راست و بالای جدول دوره ای قرار دارند. ( نافلز هیدروژن در سمت چپ جدول قرار دارد ).
- به جز دو نافلز هیدروژن و هلیم که در دستۀ s قرار دارند، بقیۀ نافلزها در دستۀ p جدول دوره ای قرار دارند.
- در دما و فشار اتاق، 7 نافلز هیدروژن، نیتروژن، اکسیژن، فلوئور، کلر، برم و ید به شکل مولکول های دواتمی (X2) وجود دارند.
- از میان نافلزهای موجود در طبیعت، تنها برم (Br2)، در دمای اتاق مایع است. کربن، فسفر، گوگرد سلنیم و ید، جامد و دیگر نافلزها، گاز هستند؛ یعنی بیشتر نافلزها در دمای اتاق، گاز هستند.
مایع < جامد < گاز : مقایسۀ شمار نافلزها با حالت فیزیکی متفاوت در دمای اتاق
3- ویژگی شبه فلزها | شیمی یازدهم
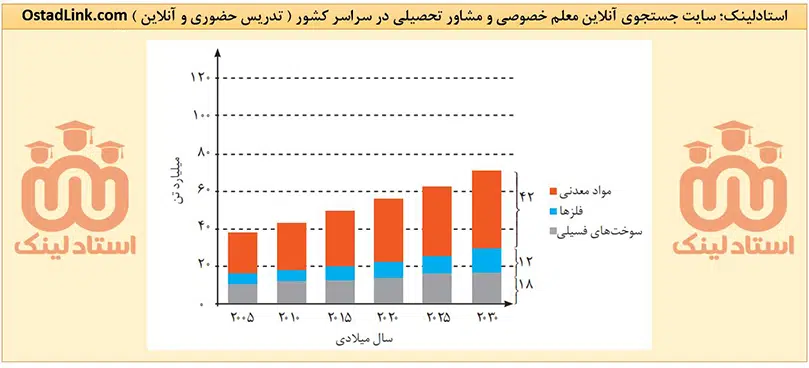
خواص فیزیکی شبه فلزها بیشتر به فلزها شبیه بوده، در حالی که رفتار شیمیایی آنها همانند نافلزها است. در کتاب درسی به شبه فلز سیلیسیم (Si) و ژرمانیم (Ge) اشاره شده است. این دو شبه فلز رسانایی الکتریکی کمی داشته، اما رسانایی گرمایی بالایی دارند.
این عنصرها همانند فلزها درخشان بوده، اما از طرفی مانند نافلزها شکننده هستند و در اثر ضربه خرد می شوند. در ضمن این دو شبه فلز مانند نافلزها در واکنش با دیگر اتم ها الکترون به اشتراک می گذارند.
نکات شبه فلزها | آموزش شیمی یازدهم
- لزوماً همۀ خواص فیزیکی شبه فلزها، به فلزها شبیه نیست. به طور مثال فلزها در اثر ضربه خرد نمی شوند، ولی همانطور که دیدید دو شبه فلز Si و Ge در اثر ضربه خرد می شوند.
- همۀ شبه فلزها به دستۀ p جدول دوره ای تعلق دارند. این عنصرها در جدول دوره ای مانند مرزی بین فلزها و نافلزها قرار دارند. عنصرهایی که در سمت راست این شبه فلزها قرار دارند، نافلز و عنصرهایی که در سمت چپ این شبه فلزها قرار گرفته اند، فلز هستند. ( البته به جز هیدروژن که یک نافلز است ).
- بدانید که در هر دوره ( به جز دورۀ اول که شامل H و He است و دورۀ هفتم که چند عنصر با ویژگی های نامشخص دارد ) حداقل یک عنصر شبه فلز وجود دارد.
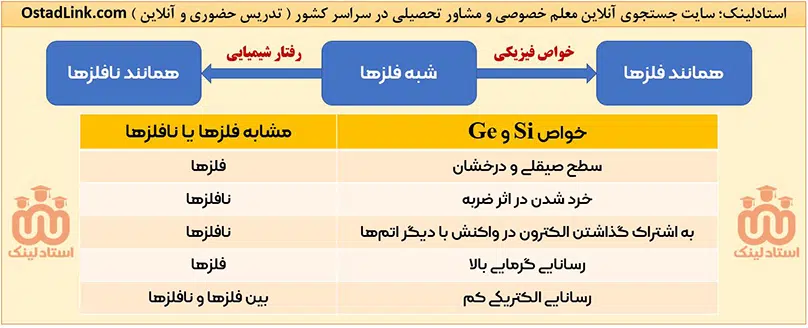
4- روند تغییر خصلت فلزی و نافلزی در جدول تناوبی
واضح است که هر چه یک عنصر تمایل بیشتری برای از دست دادن الکترون داشته باشد، خصلت فلزی آن بیشتر است و هر چه یک عنصر تمایل بیشتری برای گرفتن الکترون داشته باشد، خصلت نافلزی بیشتری دارد.
چند نکته مهم در مورد خصلت عناصر در شیمی یازدهم
- در گروه دارای فلزها، فلزهای پایین تر، خصلت فلز و فعالیت شیمیایی بالاتر و در گروه دارای نافلز، نافلزهای بالاتر، خصلت نافلزی و فعالیت شیمیایی بالاتری دارند.
- در جدول دوره ای، بیشترین خصلت فلزی مربوط به عنصر سمت چپ و پایین یعنی فرانسیم (Fr) است. در صورت صرف نظر کردن از این عنصر به دلیل پرتوزا و کمیاب بودن، سزیم (Cs) را قوی تر فلز درنظر می گیریم.
- بیشترین خصلت نافلزی مربوط به عنصر سمت راست و بالای جدول یعنی عنصر فلوئور (F) از گروه 17 است.
نکته: گازهای نجیب یا واکنش ناپذیرند و یا واکنش پذیری کمی دارند؛ بنابراین برای آنها خصلت نافلزی در نظر نمی گیریم.
5- آشنایی با عنصرهای گروه 14 و عنصرهای دورۀ 3 جدول تناوبی
در این بخش از آموزش خط به خط شیمی یازدهم به معرفی ویژگی های عنصر گروه 14 و دریف 3 جدول تناوبی می پردازیم. این بخش بسیار مهم بوده و در امتحان شیمی یازدهم و سؤالات کنکور شیمی بسیار اهمیت دارد.
عناصر گروه 14 جدول تناوبی

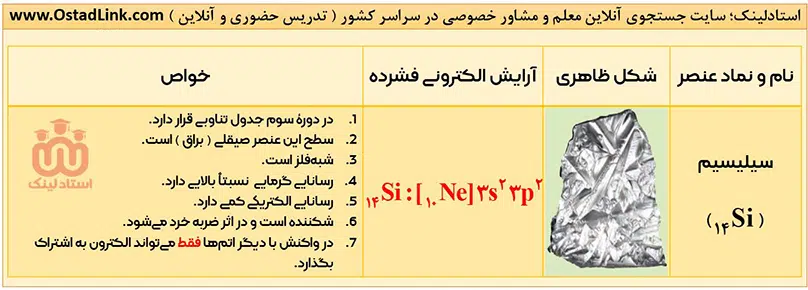
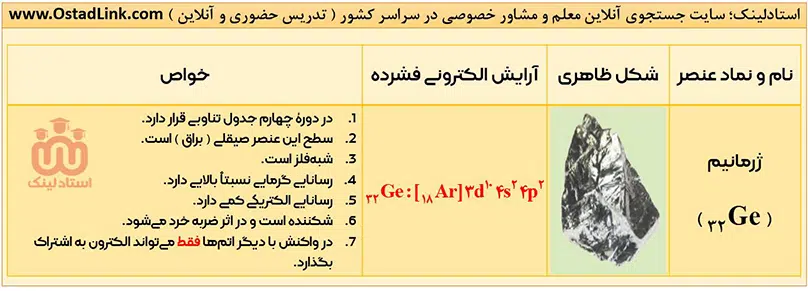
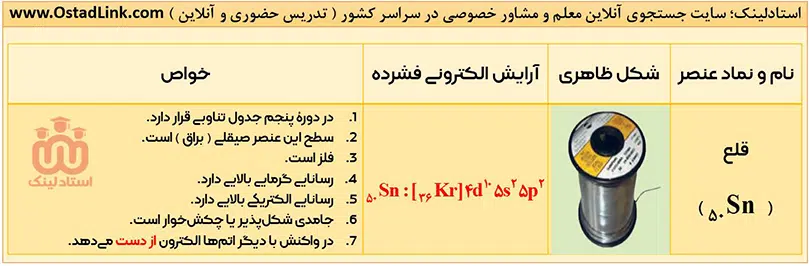
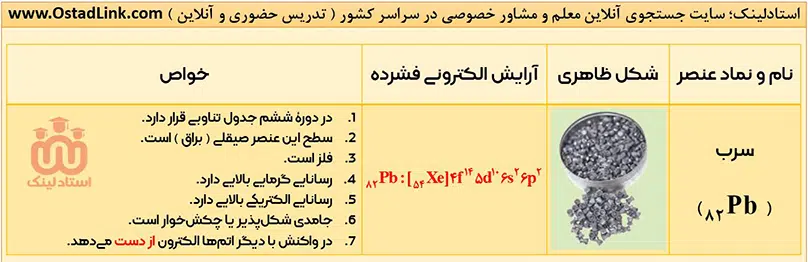
آرایش الکترونی اتم عنصرهای گروه 14 به ns2np2 ختم می شود؛ یعنی اتم همۀ عنصرهای این گروه در لایۀ ظرفیت خود، 4 الکترون دارند.
توجه: خواص گفته شده در مورد کربن در تصویر بالا، مربوط به دگرشکل گرافیت آن است.
عناصر ردیف 3 جدول دوره ای | آموزش خط به خط شیمی یازدهم
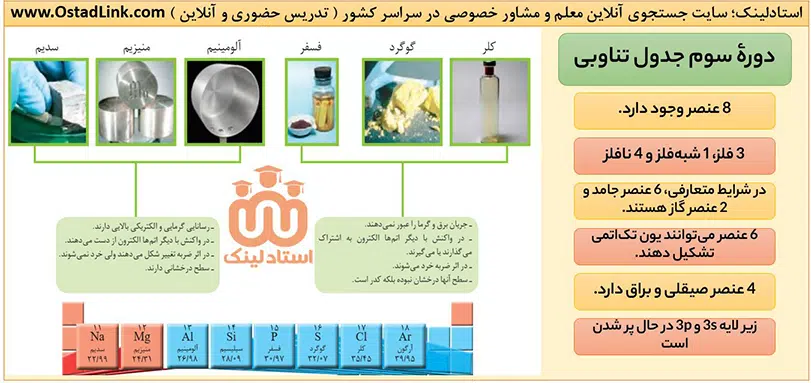
عنصرهای دورۀ سوم از سدیم (Na) و منیزیم (Mg) که متعلق به دستۀ s هستند، شروع می شود و با عنصرهای دستۀ p ادامه می یابد.
چند نکتۀ مهم در مورد عناصر ردیف 3 جدول دوره ای
1- عنصرهای سدیم، منیزیم و آلومینیوم فلز هستند؛ بنابراین رسانایی گرمایی و الکرتیکی بالا، سطح صیقلی و قابلیت چکش خواری دارند و در واکنش با دیگر اتم ها، الکترون از است می دهند.
نکته: در بین این سه فلز، سدیم به اندازه ای نرم است که می توان با چاقو آنرا برید.
2- عنصرهای فسفر، گوگرد و کلر نافلز هستند؛ بنابراین رسانایی گرمایی و الکتریکی ندارند، سطح آنها در حالت جامد، درخشان نبوده و کدر است. قابلیت چکش خواری ندارند و در اثر ضربه خرد می شوند. این اتم ها در واکنش با دیگر اتم ها یا الکترون به اشتراک می گذارند یا الکترون می گیرند.
نکته: گوگرد جامدی زردرنگ و کلر گازی زردرنگ است. فسفر نیز دگرشکل های مختلفی دارد که در کتاب درسی دو دگرشکل قرمز و سفید آن اشاره شده است. فسفر سفید را داخل آب نگهداری می کنند.
دانلود نمونه سوالات امتحانی شیمی یازدهم
تدریس خصوصی شیمی در اصفهان

برای موفقیت در امتحانات شیمی یازدهم، شیمی کنکور و امتحان نهایی شیمی، می توانید از کلاس های خصوصی شیمی سایت تدریس خصوصی استادلینک استفاده نمایید.
استادلینک با داشتن بهترین اساتید دروس مختلف در سراسر کشور و همچنین برگزاری کلاس های حضوری و آنلاین و ارائه بهترین خذمات با مناسب ترین هزینه، همواره در کنار شما دانش آموزان و داوطلبان کنکور سراسری است.
برای آگاهی از شرایط ثبت نام و جزئیات بیشتر به پشتیبانی سایت تدریس خصوصی استادلینک پیام دهید تا به شما مشاوره مناسب داده شود.
مقالات مرتبط فصل 1 آموزش شیمی یازدهم
با کلیک بر روی هر بخش زیر، می توانید به آموزش خط به حط شیمی یازدهم بخش های مختلف فصل 1 دسترسی داشته باشید.