این بخش آموزش شیمی شامل قسمت های زیر است:
9- انحلال پذیری مواد در آب
10- اثر دما بر انحلال پذیری
11- مسائل انحلال پذیری و مسائل استوکیومتری واکنش ها در محلول
9- انحلال پذیری مواد در آب
| دانلود جزوه تمامی فرمول های شیمی |
انحلال پذیری، بیشترین مقدار یک ماده برحسب گرم است که در دمای معین در 100 گرم حلال (نه محلول) حل می شود.
بر این اساس می توان مواد را برحسب مقدار انحلال پذیری آنها در آب، در دمای معین، به سه دشته تقسیم کرد:
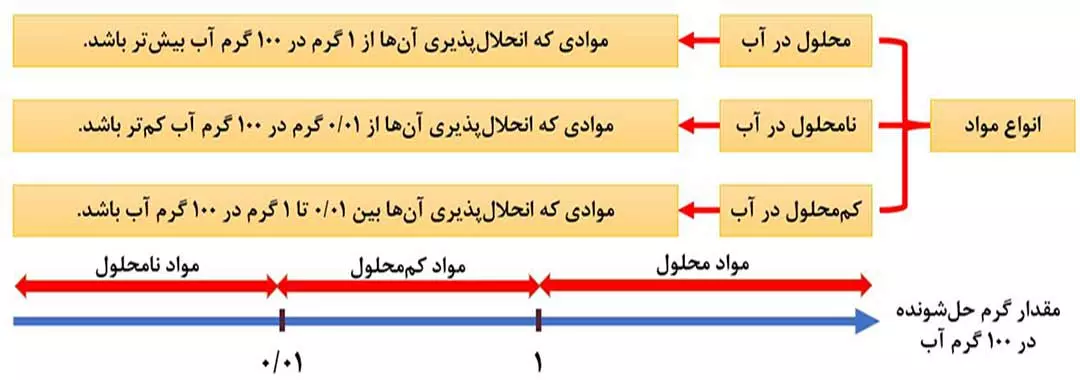
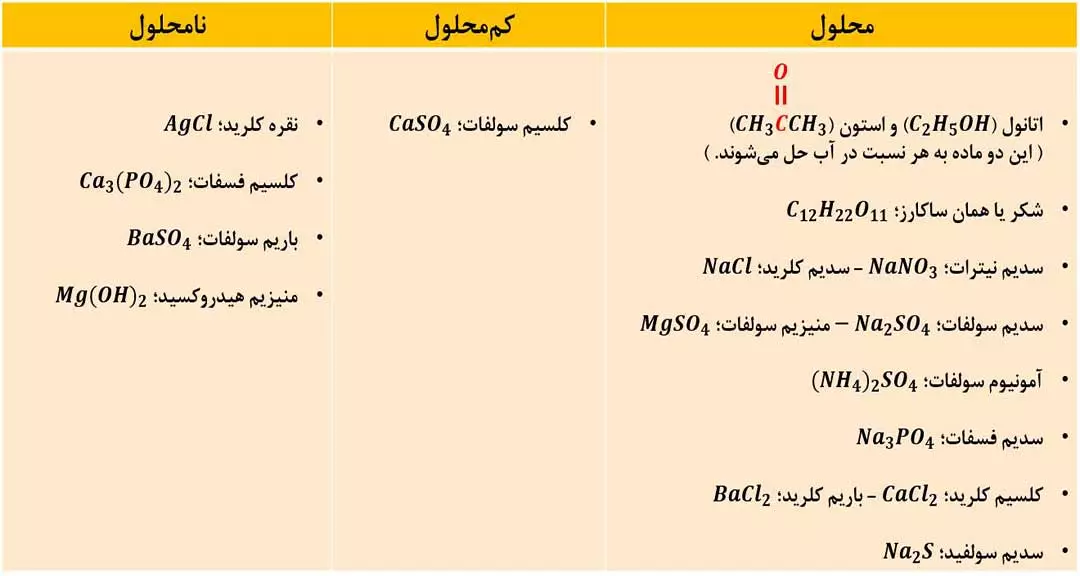
همۀ مواد محلول، کم محلول و نامحلولی که باید ( در دمای 25 سانتی گراد ) به خاطر داشته باشید، در جدول زیر است:
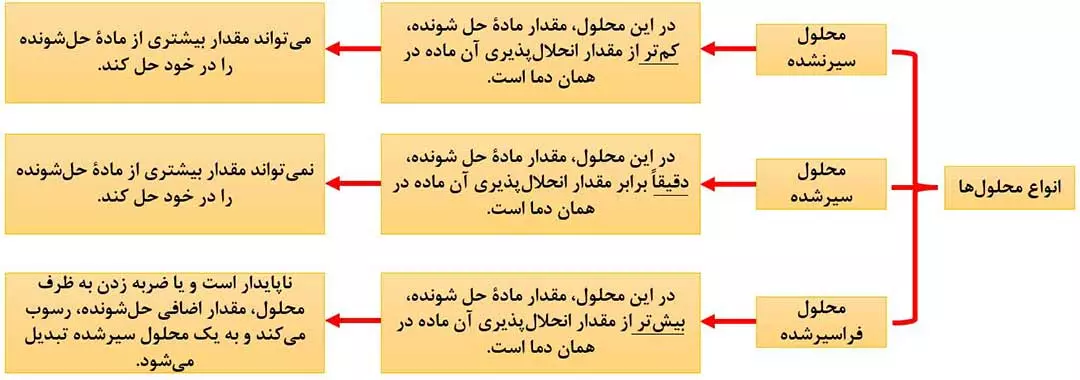
محلول ها را می توان برحسب مقدار مادۀ حل شندۀ موجود در آنها به سه دستۀ زیر تقسیم کرد:
چند نکته:
1) برای تشخیص محلول سیرنشده، سیرشده و فراسیرشده کافی است مقدار کمی از مادۀ حل شونده را به محلول مورد نظر اضافه کنیم. در این صورت 3 حالت زیر اتفاق می افتد:
- مقدار اضافه شده، حل می شود. ===> محلول سیر نشده است.
- همان مقدار اضافه شده، رسوب می کند. ===> محلول سیرشده است.
- بیشتر از مقدار اضافه شده، رسوب می کند. ===> محلول فراسیرشده است.
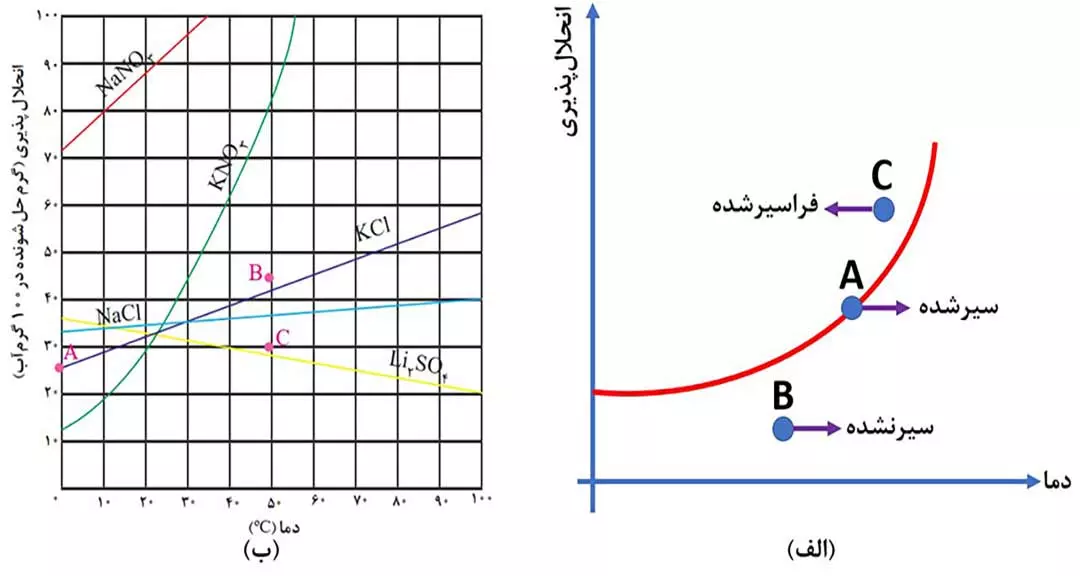
2) به نموداری که اثر دما را بر انحلال پذیری یک ماده نشان می دهد، منحنی انحلال پذیری – دما می گویند.
هر نقطه روی منحنی، نشان دهندۀ محلول سیر شده ( مانند شکل 4 – الف نقطۀ A )، هر نقطه زیر منحنی نشان دهندۀ محلول سیرنشده ( مانند شکل 4 – الف نقطۀ B ) و هر نقطه بالای منحنی نشان دهندۀ یک محلول فراسیرشده ( مانند شکل 4 – الف نقطۀ C ) در آن دما است.
10- اثر دما بر انحلال پذیری
یکی از عوامل موثر بر انحلال پذیری مواد در آب، دما است. با توجه به ( شکل 4 – ب ) داریم:
- نمودار انحلال پذیری برخی مواد ( مانند KNO3 و KCl و NaNO3 ) برحسب دما، صعودی است؛ یعنی با افزایش دما، انحلال پذیری آنها افزایش می یابد.
- نمودار انحلال پذیری برخی از مواد ( مانند Li2SO4 ) برحسب دما نزولی است؛ یعنی با افزایش دما، انحلال پذیری آنها کم می شود.
- نموداز انحلال پذیری برخی مواد ( مانند NaCl ) برحسب دما به صورت تقریباً افقی است؛ یعنی تغییر دما تاثیر چندانی بر انحلال پذیری آنها ندارد.
توجه: هر چق قدرمطلق شیب نمودار انحلال پذیری یک ماده بیشتر باشد، تاثیر دما بر انحلال پذیری آنها بیشتر است. با توجه به نمودار رسم شده، تاثیر دما بر انحلال پذیری KNO3 از همه بیشتر و بر انحلال پذیری NaCl از همه کمتر است.
11- مسائل انحلال پذیری و مسائل استوکیومتری واکنش ها در محلول
در این ویدئوی آموزشی با مسائل بخش انحلال پذیری و تفسیر نمودارهای آن، و مسائل استوکیومتری واکنش ها در محلول ها آشنا خواهید شد.
پایان بخش3 فصل2 آموزش خط به خط شیمی دهم. کاری از سایت جستجوی معلم خصوصی استادلینک.
مقالات مرتبط فصل3 شیمی1
بخش صفر – اهمیت شیمی در کنکور سراسری
بخش اول – منابع آب کرۀ زمین – یون های چنداتمی



















