این بخش شامل قسمت های زیر است:
11- مقدمه ای بر جدول دوره ای عنصرها
12- جرم اتمی عنصرها
13- جرم اتمی میانگین
11- مقدمه ای بر جدول دوره ای عنصرها
| دانلود جزوه تمامی فرمول های شیمی |
شیمیدان ها برای بررسی و دسترسی آسان تر و سریع تر عنصرها، آنها را در جدولی به نام جدول دوره ای ( تناوبی ) طبقه بندی کرده اند.
در جدول دوره ای ( تناوبی ) امروزی، عنصرها بر اساس افزایش عدد اتمی در کنار هم چیده شده اند؛ به طوری که این جدول از عنصر هیدروژن با عدد اتمی 1 آغاز شده و به عنصر 118 ختم می شود.
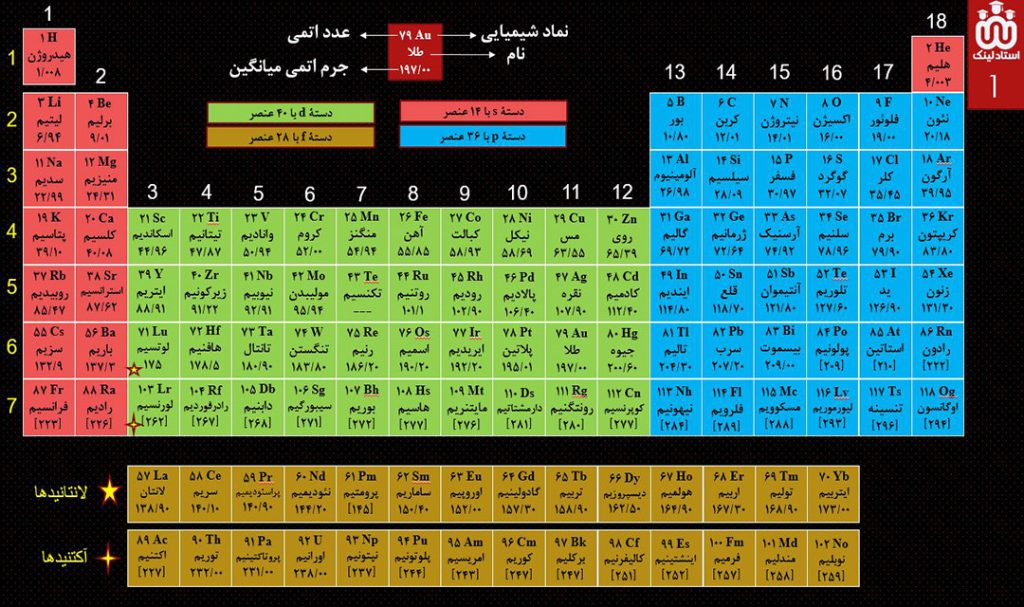
برای دانلود pdf جدول تناوبی، طراحی شده توسط تیم استادلینک، اینجا ضربه بزنید.
نکات جدول تناوبی
1- این جدول دارای 7 ردیف افقی است که دوره یا تناوب نامیده و با نماد n بیام می شود. خواص شیمیایی عنصرهایی که در یک دوره از جدول قرار دارند، با هم متفاوت است.
2- این جدول دارای 18 ستون عمودی است که گروه نامیده می شود. عنصرهایی که در یک گروه قرار دارند، به طور کلی خواص شیمیایی مشابهی دارند. به طور مثال همۀ عنصرهای گروه 17، می توانند آنیونی با یک بار منفی ( –X ) تشکیل دهند
توجه: با پیمایش هر دوره از چپ به راست، خواص عنصرها به طور مشابه تکرار می شود. به همین خاطر به این جدول، جدول دوره ای ( تناوبی ) عنصرها می گویند.
3- هر خانه از جدول تناوبی به یک عنصر معین تعلق دارد و عدد اتمی عنصر، نماد شیمیایی، نام آن و همچنین جرم اتمی میانگین عنصر، در آن مشخص شده است.
4- نماد شیمیایی عنصرها یک یا دو حرفی است که حرف اول نام لاتین به صورت بزرگ و حرف حرف دوم ( در صورت دو حرفی بودن نماد ) به صورت کوچک نوشته می شود. اغلب عنصرها نماد شیمیایی دوحرفی دارند.
مثلا: Al = آلومینیوم ، Ar = آرگون ، Au = طلا Be = بریلیم ، B = بور ، Br = برم N = نیتروژن ، Ne = نئون ، Na = سدیم Pb = سرب ، Pt = پلاتین ، Pd = پالادیم.
5- دو ردیف از عنصرها در پایین جدول قرار گرفته اند:
ردیف اول ( لانتانیدها ): عنصرهایی با عدد اتمی 57 تا 70 ( 14 عنصر ) => این عناصر متعلق به گروه 3 و دورۀ 6 است.
ردیف دوم ( آکتنیدها ): عنصرهایی با عدد اتمی 89 تا 102 ( 14 عنصر ) => این عناصر متعلق به گروه 3 و دورۀ 7 است.
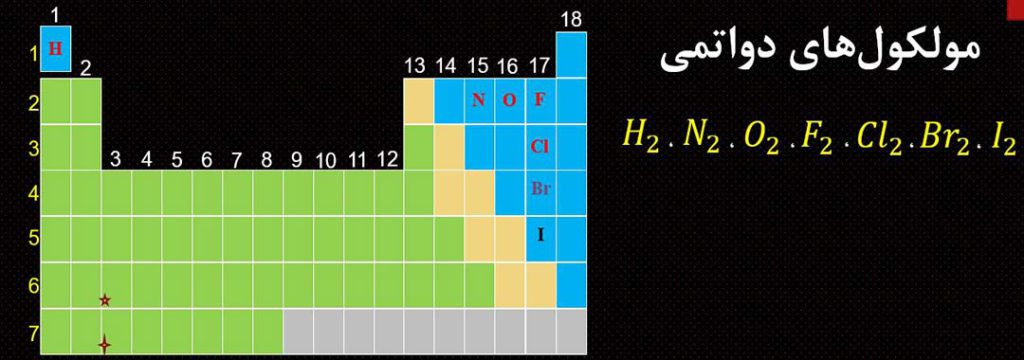
6- در جدول دوره ای، 7 عنصر وجود دارد که در دما و فشار اتاق به شکل مولکول های دواتمی وجود دارد.
( I2 , Br2 , Cl2 , F2 , O2 , N2 , H2 )
توجه: برای آنکه از عهدۀ سوالات مرتبط با جدول تناوبی ( به خصوص سوالات آرایش الکترونی ) بربیایین، بهتر است که نماد شیمیایی و عدد اتمی عنصرهای چهار دورۀ اول، یعنی عنصر 1 تا 36 را بخاطر بسپارید. همچنین نماد شیمیایی و عدد اتمی همۀ عناصر گروه 1، 2، 14، 17 و 18 را بخوبی حفظ کنید.
12- جرم اتمی عنصرها
همانطور که می دانید، جرم اجسام گوناگون را بسته به اندازه و نوع آنها با ترازوهای مختلف، با دقت اندازه گیری متفاوت، اندازه گیری می کنند. کاملا واضح است که اگر جرم جسمی کمتر از دقت اندازه گیری ترازو باشد، نمی توان جرم جسم را با آن ترازو اندازه گیری کرد. به طور کلی مقادیری که ضریب صحیحی از دقت اندازه گیری یک ترازو باشند را می توان با آن ترازو اندازه گیری کرد.

از آنجایی که اتم ها بسیار ریز هستند و ما نمی توانیم به صورت مستقیم جرم آنها را اندازه گیری کنیم، دانشمندان مقیاس جرم نسبی را برای تعیین جرم اتم ها به کار می برند. مطابق این مقیاس، جرم اتم ها را با یکای جرم اتمی ( amu ) که معادل یک دوازدهم جرم ایزوتوپ کربن-12 است، می سنجند. یکای جرم اتمی را با نماد u نیز نشان می دهند.
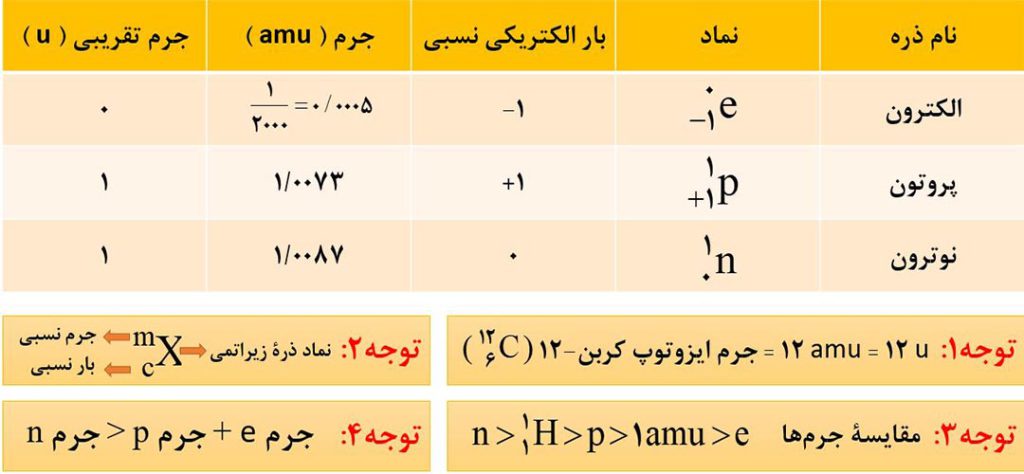
توجه: از آنجا که جرم پروتون و نوترون در حدود 1amu بوده و جرم الکترون هم ناچیز است، مقدار عددی جرم یک اتم برحسب amu به تقریب، برابر با عدد جرمی آن ( مجموع تعداد پروتون ها و نوترون ها ) است.
بعنوان مثال، لیتیم دارای 3 پروتون و 4 نوترون و دارای عدد جرمی 7 و عدد اتمی 3 است. جرم لیتیم به تقریب، 7amu است.
تمرین1– جرم لیتیم را به طور دقیق محاسبه کنید و نتیجۀ آنرا با جواب تقریبی بالا مقایسه فرمایید.
تمرین2- جرم دقیق اتم کربن-12 را بر حسب amu بدست آورید.
تمرین3- یک amu را تعریف کنید.
توجه: جرم اتمی اکثر عنصرها در جدول دوره ای به صورت عدد اعشاری است ولی عدد جرمی ( A ) همۀ عناصر، یک عدد صحیح می باشد. دلیل اعشاری بودن جرم اتمی یک عنصر، وجود ایزوتوپ های متفاوت آن عنصر با جرم های متفاوت است. در واقع جرم نوشته شده در جدول دوره ای، جرم اتمی میانگین عنصرها است.
13- جرم اتمی میانگین
در این آموزش با مفهوم جرم اتمی میانگین، روش سریع محاسبۀ جرم اتمی میانگین و حل دستگاه سه معادله و سه مجهول به روش جایگذاری آشنا خواهید شد.
آموزش ویدئویی محاسبۀ جرم اتمی میانگین ( شیمی 1 پایه دهم )
مقالات مرتبط فصل1 شیمی1
فصل1 – بخش صفر – اهمیت شیمی در کنکور سراسری
فصل1 – بخش اول – تبدیل واحدها – رابطۀ انیشتین
فصل1 – بخش دوم – ذرات زیر اتمی – ایزوتوپ ها
فصل1 – بخش چهارم – مول چیست؟ – آموزش استوکیومتری
فصل1 – بخش پنجم – نور کلید شناخت جهان هستی – طیف نشری هیدروژن



















