این بخش آموزش شیمی شامل قسمت های زیر است:
12- رفتار مولکول های قطبی و ناقطبی در میدان الکتریکی
13- نیروهای بین مولکولی و مقایسۀ نقطۀ جوش مواد
14- پیوند هیدروژنی
15- نیروهای بین مولکولی آب، فراتر از انتظار
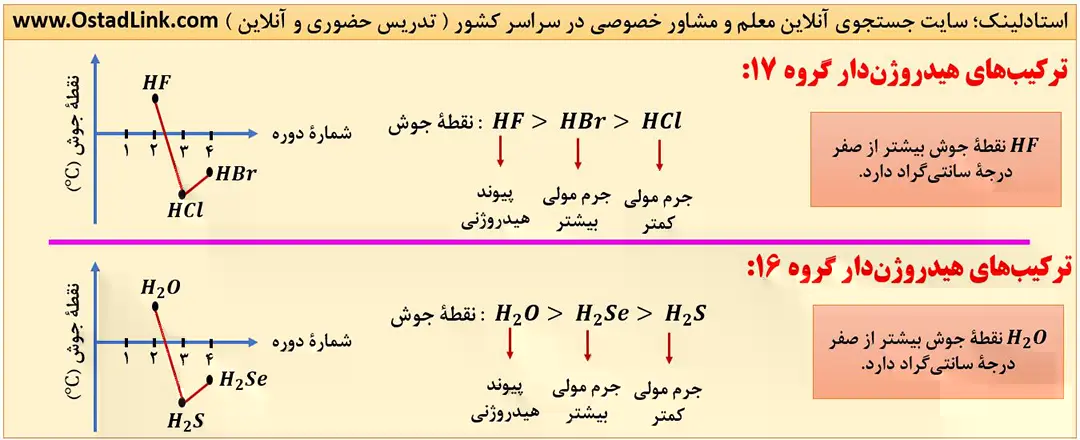
16- مقایسۀ نقطۀ جوش ترکیب های هیدروژن دار عنصرهای گروه های 14 تا 17 جدول تناوبی
12- رفتار مولکول های قطبی و ناقطبی در میدان الکتریکی
| دانلود جزوه تمامی فرمول های شیمی |
اگر دو صفحه رسانا را به دو قطب یک باتری متصل کنیم، یک میدان الکتریکی بین دو صفحه ایجاد می شود. در این حالت، صفحۀ رسانای متصل به قطب منفی، دارای بار منفی و صفحۀ رسانای متصل به قطب مثبت، دارای بار مثبت می شود. ( در باتری ها، خط بلند نشان دهندۀ قطب مثبت و خط کوتاه نشان دهندۀ قطب منفی است ).
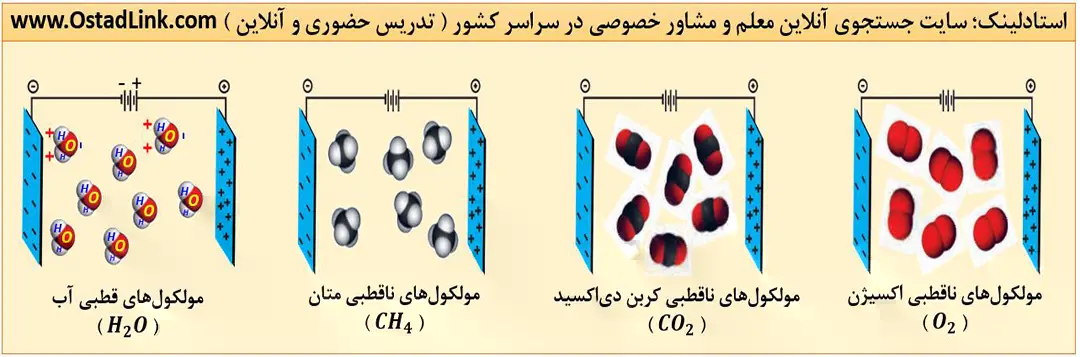
فرض کنید مولکول های آب در این میدان الکتریکی قرار گیرند، همان طور که می بینید همه مولکول های آب هم جهت شده اند، به طوری که اتم های هیدروژن به سمت صفحه با بار منفی و اتم اکسیژن به سمت صفحه با بار مثبت قرار دارند؛ بنابراین می توان نتیجه گرفت که اتم های هیدروژن سر مثبت و اتم اکسیژن سر منفی
مولکول آب را تشکیل می دهند.
شکل مولکول های آب به صورت خمیده (V شکل) است. جهت گیری مولکولهای آب در میدان الکتریکی از نوع اتم های سازنده و ساختار خمیده آن ناشی می شود.
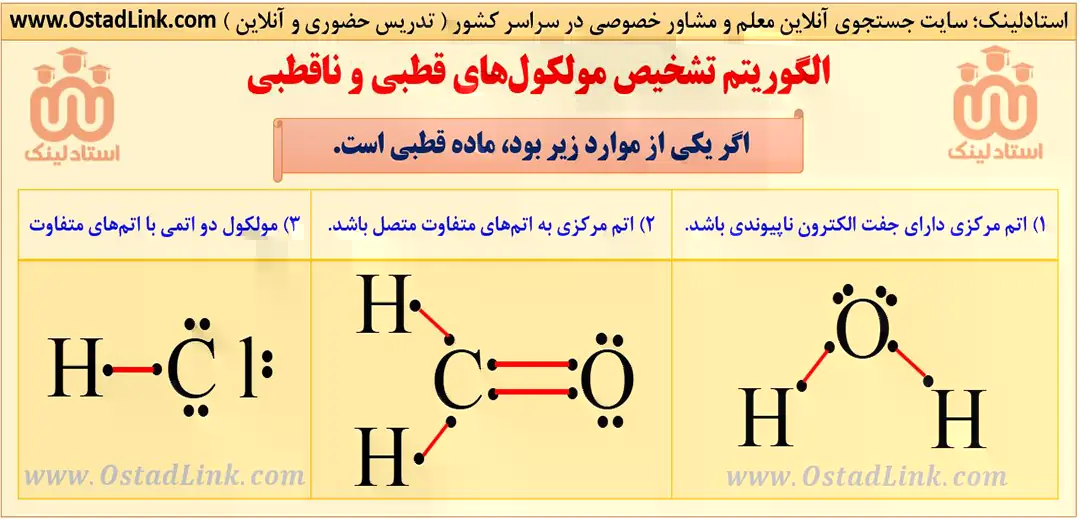
به مولکول هایی مانند آب که در میدان الکتریکی جهت گیری می کنند، مولکول های دوقطبی یا قطبی می گویند. این مولکول ها دارای سر مثبت و منفی هستند. در حد کتاب درسی بدانید که همه مولکول های دو اتمی با اتم های متفاوت (مانند CO ،HF ،HCl و NO ) مولکول های H2O، H2S ، NH3 و PH3 قطبی هستند.
به مولکول هایی که در میدان الکتریکی جهت گیری نمی کنند، مولکول های ناقطبی می گویند. همۀ مولکول های دو اتمی با اتم های یکسان ( مانند F2 و O2 ) و مولکول های CO2 و CH4 ناقطبی هستند.
الگوریتم تشخیص مولکول های قطبی و ناقطبی در شیمی
از آنجایی که مولکول های آب قطبی هستند، اگر یک میله باردار را به باریکه آب نزدیک کنیم، مشاهده خواهیم کرد که جریان آب از مسیر خود منحرف و به میله نزدیک می شود. بدانید و آگاه باشید که میله شیشه ای از لحاظ بار الکتریکی خنثی است، اما بر اثر مالش به موی خشک دارای بار الکتریکی منفی می شود.

13- نیروهای بین مولکولی و مقایسۀ نقطۀ جوش مواد
به برهم کنش های میان مولکول های سازنده یک ماده، نیروهای بین مولکولی گفته می شود.
نیروهای بین مولکولی نقش مهمی در حالت فیزیکی و خواص یک ترکیب مولکولی دارند. نیروهای بین مولکولی یک مادۀ معین، در حالت جامد قوی تر از حالت مایع و آن هم به مراتب قوی تر از حالت گاز است. ( شکل 4 – الف )

نیروهای بین مولکولی به قطبی بودن مولکول ها و جرم و حجم آنها بستگی دارد.
- قطبیت مولکول: در مواد مولکولی با جرم مولی تقریباً یکسان، ماده با مولکول های قطبی، نیروهای بین مولکولی قوی تری نسبت به ماده با مولکول های ناقطبی داشته، در نتیجه نقطه جوش آن بالاتر است. ( شکل 4 – ب )
- جرم و حجم مولکول: در مواد مولکولی با مولکول های ناقطبی، با افزایش جرم مولی و حجم مولکول، نیروهای بین مولکولی قوی تر جوش افزایش می یابد. ( شکل 4 – پ )
چند نکته:
1) همواره نیروهای بین مولکولی در مواد قطبی قوی تر از مواد ناقطبی نیست. در برخی موارد، جرم و حجم مولکول ناقطبی به قدری زیاد است که نیروهای بین مولکولی آن قوی تر از یک مولکول قطبی می شود.
مثلاً می دانیم که ماده ناقطبی ید ( I2 ) در دمای اتاق جامد و مادة قطبی هیدروژن کلرید ( HCl ) در دمای اتاق گاز است؛ پس قطعاً نیروی بین مولکولی در I2 قوی تر می باشد؛ بنابراین در این جا جرم و حجم زیاد I2 بر قطبی بودن HCI غلبه کرده است.
2) هر چه نقطه جوش یک گاز بالاتر باشد، راحت تر به مایع تبدیل می شود؛ یعنی هنگامی که چند گاز را سرد می کنیم. ابتدا آن گازی مایع می شود که
نیروهای بین مولکولی قوی تر دارد و نقطه جوش آن بالاتر است.
مثال: دو گاز نیتروژن (N2) و کربن مونوکسید (CO) جرم مولی یکسانی دارند. از آنجا که CO قطبی و N2 ناقطبی است، می توان فهمید که CO نقطه جوش بالاتری دارد؛ بنابراین با سرد کردن، CO آسان تر به مایع تبدیل می شود. ( توجه شود که جرم مولی N2 و CO هز دو 28 گرم بر مول است ).
14- پیوند هیدروژنی
پیوند هیدروژنی، قوی ترین نیروی جاذبه بین مولکولی است که میان اتم هیدروژن (H) متصل به یکی از اتم های F و O یا N از یک مولکول با یکی از اتم های F و O یا N از مولکول مجاور تشکیل می شود.
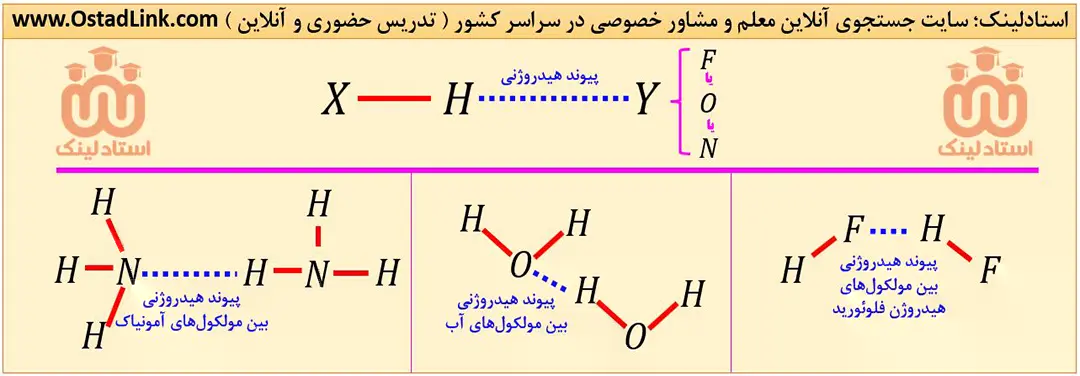
همه نیروهای جاذبه بین مولکولی به جزء پیوندهای هیدروژنی را نیروهای واندروالسی می گویند.
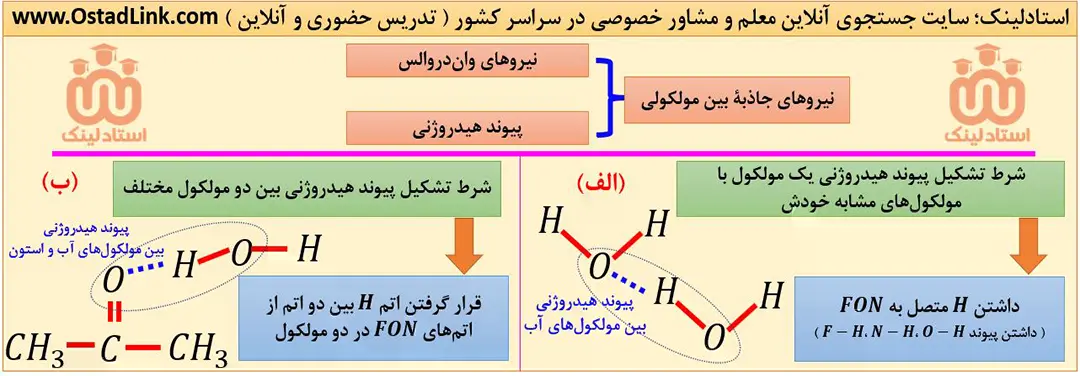
ترکیب هایی که در ساختار خود پیوند (H-F)، (H-O) یا (H-N) دارند، می توانند با مولکول های خود پیوند هیدروژنی تشکیل دهند؛ به طور مثال همانطور که دیدید، بین مولکول های آب پیوند هیدروژنی برقرار می شود.
توجه: به طور کلی اگر اتم هیدروژن (H) بین دو اتم از اتم های FON در دو مولکول باشد، آن پیوند هیدروژنی است. به این ترتیب برخی از اتم ها در ساختار خود پیوند (H-F)، (H-O) یا (H-N) ندارند، ولی می توانند با یک مولکول دیگر، پیوند هیدروژنی تشکیل دهند. به طور مثال استون نمی تواند با مولکول های خود پیوند هیدروژنی تشکیل دهد ولی با مولکول های آب می تواند پیوند هیدروژنی تشکیل دهد.

هر چند پیوند هیدروژنی از دیگر نیروهای جاذبۀ بین مولکولی بسیار قوی تر است، اما از پیوند اشتراکی (کووالانسی) بین ائم ها (و همچنین پیوند یونی بین یون ها) ضعیف تر میباشد؛ به همین دلیل برخلاف پیوندهای اشتراکی، پیوندهای هیدروژنی به صورت نقطه چین نشان داده می شوند.
اغلب ترکیب های دارای پیوند هیدروژنی، نسبت به ترکیب های فاقد پیوند هیدروژنی، نقطه جوش بالاتری دارند. به طور مثال نقطه جوش HF به دلیل پیوند هیدروژنی، بیشتر از نقطه جوش HCl است.
توجه: گفتیم «اغلب»؛ چون در برخی موارد جرم و حجم یک مولکول به قدری زیاد است که بر پیوند هیدروژنی هم غلبه می کند. به طور مثال I2 در دمای اتاق جامد و HF گاز است و این یعنی این که نیروهای بین مولکولی در I2 به دلیل جرم و حجم بیشتر حتی از پیوند هیدروژنی بین مولکول های HF فوی تر است و I2 نقطه جوش بالاتری دارد. ( شکل 8 – الف )
15- نیروهای بین مولکولی آب، فراتر از انتظار
در جدول زیر برخی از ویژگی های آب (H2O) در مقایسه با هیدروژن سولفید (H2S)، در فشار 1atm آمده است.
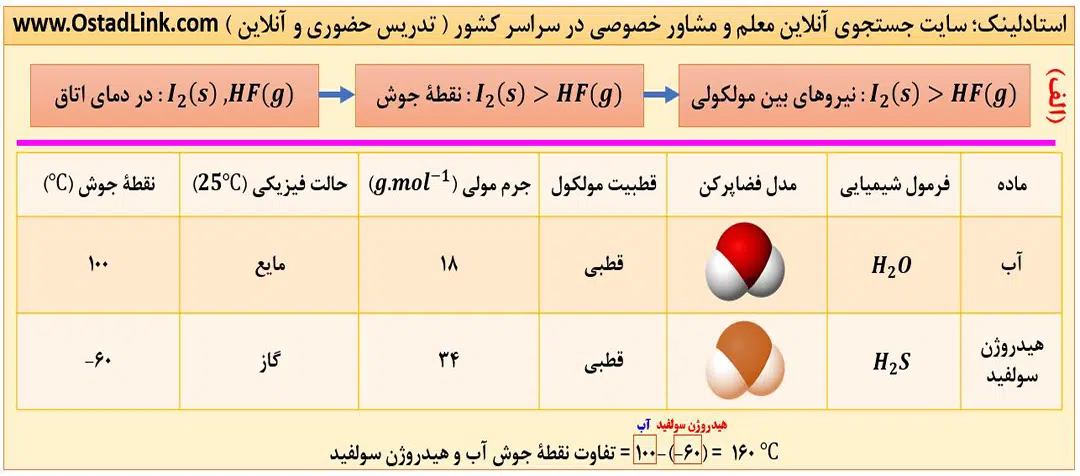
همان طور که می بینید هر دو ترکیب دارای مولکول های خمیده و قطبی هستند و با این که جرم مولی آب تقریباً نصف جرم مولی هیدروژن سولفید است، اما نقطه جوش آب بسیار بالاتر از نقطه جوش هیدروژن سولفید می باشد.
با توجه به این که هر دو مولکول قطبی هستند. دلیل تفاوت زیاد در نقطه جوش و حالت فیزیکی این دو ماده در دمای اتاق ، به دلیل وجود پیوند هیدروژنی میان مولکول های آب است.
آب تنها ماده ای است که در طبیعت به هر سه حالت جامد، مایع و گاز (بخار) یافت می شود.
در این جا می خواهیم پیوندهای هیدروژنی آب را در هر یک از این سه حالت بررسی کنیم:
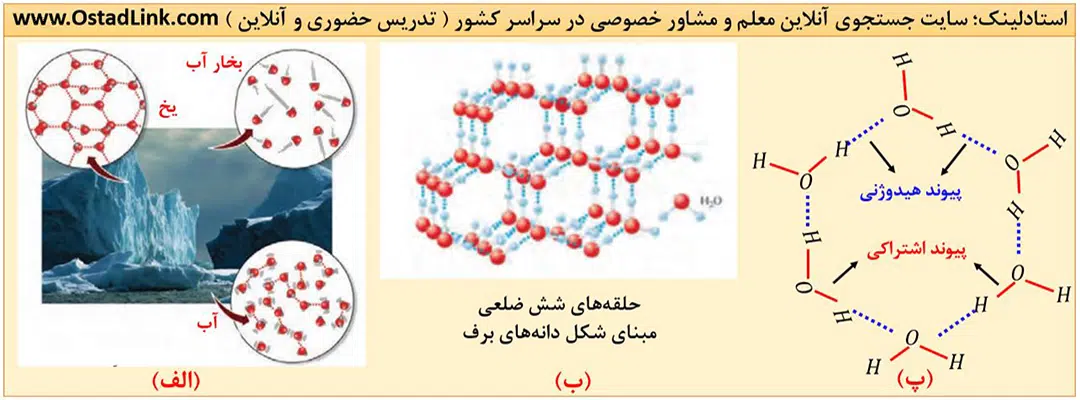
- در حالت گاز یا بخار، فاصله بین مولکول های H2O بسیار زیاد بوده و مولکول ها عملاً از هم جدا هستند، گویی میان آنها پیوندهای هیدروژنی وجود ندارد.
- در حالت مایع، فاصله بین مولکول های H2O در مقایسه با حالت گاز بسیار کمتر است. در این حالت، مولکول ها پیوندهای هیدروژنی قوی دارنده با این وجود روی هم میلغزند و جابه جا می شوند.
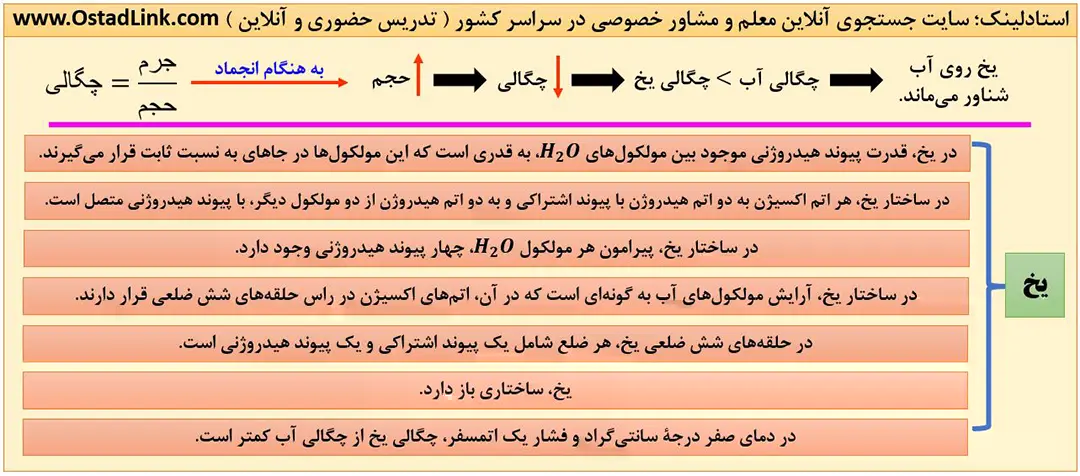
- در حالت جامد، مولکول های آب در جاهای به نسبت ثابت قرار دارند و هر مولکول آب می تواند با چهار مولوکول مجاور خود، پیوند هیدروژنی تشکیل دهد. با تشکیل پیوندهای هیدروژنی میان مولکول های آب در حالت جامد، شبکه ای با حلقه های شش ضلعی ایجاد می شود که داخل آن فضاهای خالی وجود دارد و اتم اکسیژن در راس این حلقه ها قرار دارند.
در واقع یخ ساختاری باز دارد؛ به همین دلیل برخلاف دیگر مواد، حجم آب هنگام انجماد افزایش می یابد. با توجه به ثابت بودن جرم آب و افزایش حجم آن به هنگام پخ زدن، چگالی صفر درجه، کمتر است.
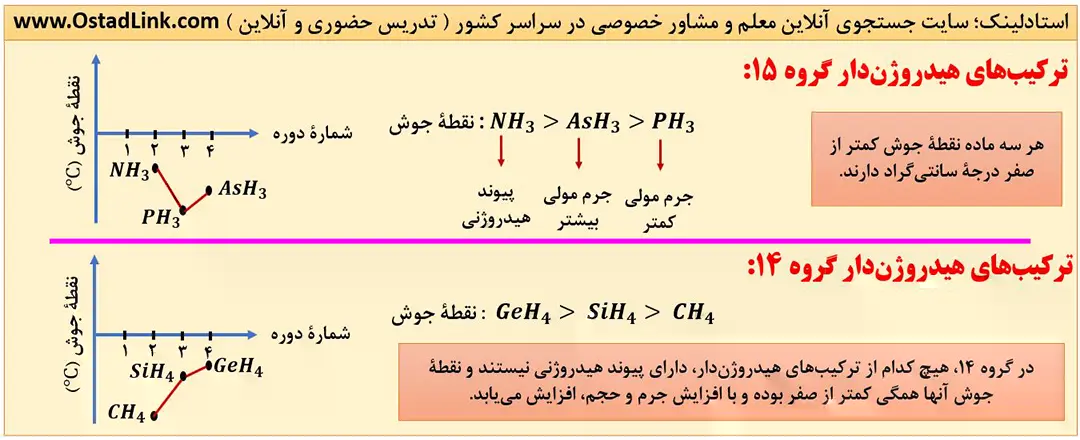
16- مقایسۀ نقطۀ جوش ترکیب های هیدروژن دار
این قسمت بسیار سوال خیز بوده پس با دقت آنرا مطالعه نمایید.
پایان آموزش خط به خط بخش 4 فصل 3 شیمی دهم. کاری از سایت تدریس خصوصی استادلینک.
مقالات مرتبط:
بخش صفر – اهمیت شیمی در کنکور سراسری
بخش اول – منابع آب کرۀ زمین – یون های چنداتمی



















