این بخش آموزش شیمی شامل قسمت های زیر است:
6- محلول و اجزای سازندۀ آن
7- ppm، درصد جرمی و غلظت مولی (مولار)
8- استخراج مواد شیمیایی موجود در آب دریا
6- محلول و اجزای سازندۀ آن
| دانلود جزوه تمامی فرمول های شیمی |
یکی از روش های طبقه بندی مواد به صورت زیر است:
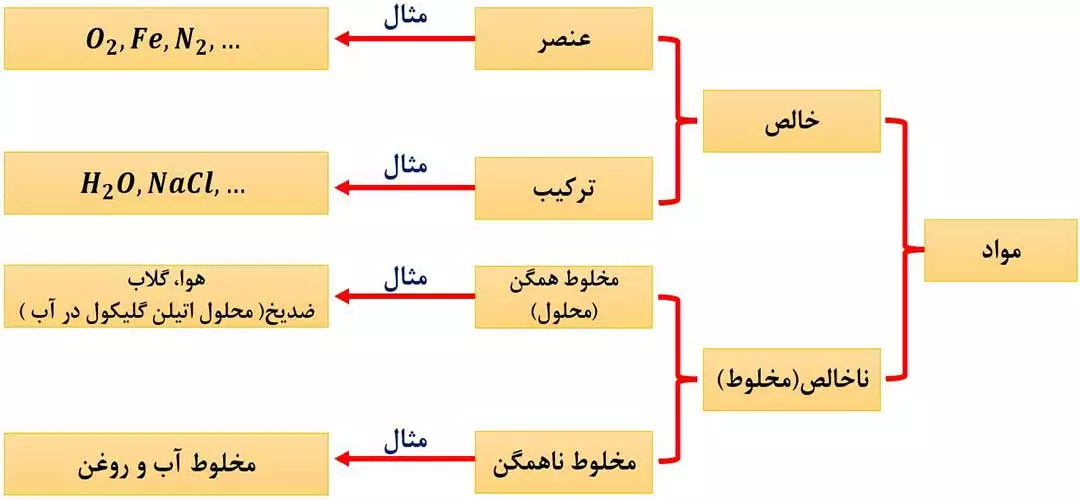
ما در این قسمت با محلول ها سروکار داریم.
به مخلوطی که حالت فیزکی و ترکیب شیمیایی در سرتاسر آن یکسان باشد، محلول می گویند؛ به طور مثال در محلول نمک خوراکی در آب ( مانند سرم فیزیوتراپی )، حالت فیزیکی در سرتاسر آن، مایع بوده و مانند رنگ و غلظت، ترکیب شیمیایی آن در سرتاسر محلول یکسان و یکنواخت است.
چند نکته:
- محلول ها به هر سه حالت فیزیکی گاز (مانند هوا)، مایع (مانند محلول آب و اتانول) و جامد (مانند انواع آلیاژها) وجود دارند.
- آب دریا، رودخانه و آب آشامیدنی هیچ کدام خالص نیستند و همگی محلول به شمار می آیند.
- جلوتر خواهیم خواند بنزین یک نمونه از محلول های غیرآبی است.
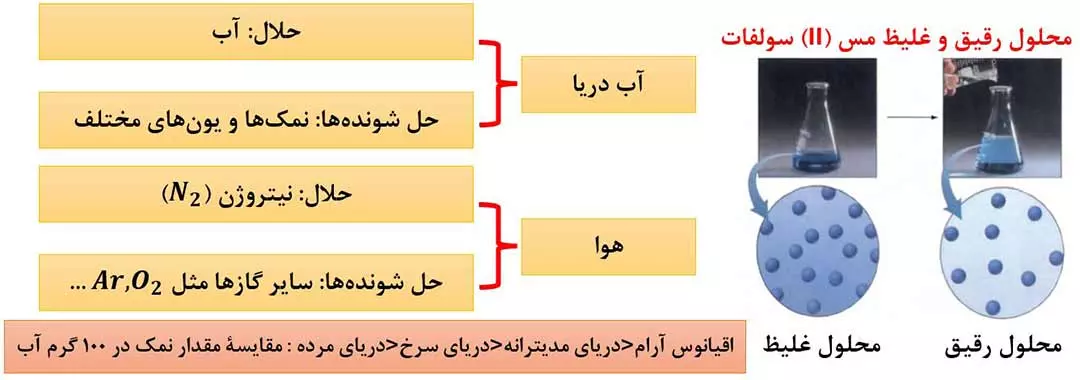
- هر محلول از دو جزء حلال و حل شونده تشکیل شده است. حلال جزئی است که حل شونده را در خود حل کرده و نسبت به حل شونده، شمار مول های بیشتری دارد.
- برخی از محلول ها از یک حلال و چند حل شونده تشکیل شده اند. ( شکل 2 )
- با توجه به مقدار حل شونده (ها) در یک محلول می توان محلول ها را به دو دستۀ «رقیق» و «غلیظ» تقسیم کرد.
محلول رقیق محلولی است که مقدار حل شونده (ها)ی آن در واحد حجم کم است؛ مانند سرم فیزیولوژی.
محلول غلیظ محلولی است مه مقدار حل شونده (ها)ی آن در واحد حجم کم است؛ مانند گلاب دو آتیشه.
توجه: آب دریای مرده (بحرالمیت) محلول غلیظی است که انسان می تواند به راحتی روی آن شناور بماند.
بدانید که مقدار نمک های حل شده در آب دریاهای گوناگون با هم متفاوت است. هر چه میزان نمک های حل شده در آب دریا بیشتر باشد، چگالی آب دریا بیشتر شده و حتی ممکن است انسان روی آن آب، شناور بماند.
7- ppm، درصد جرمی و غلظت مولی (مولار)
در ویدئوی انیمیشنی زیر، با سه روش بیان غلظت یک محلول ( قسمت در میلیون یا ppm، درصد جرمی و غلظت مولی یا مولار ) آشنا می شوید.
ویدئوی انواع کسرها در محلول ها
8- استخراج مواد شیمیایی موجود در آب دریا
- مواد شیمیایی موجود در آب دریا را می توان به روش های فیزیکی (مانند تهیۀ سدیم کلرید به روش تبلور) یا شیمیایی (مانند تهیۀ فلز منیزیم) از آن جدا کرد.
- در روش تبلور، آب دریا وارد حوضچه های تبخیر می شود و به کمک نور خورشید، آب تبخیر شده و نمک بر جای می ماند.
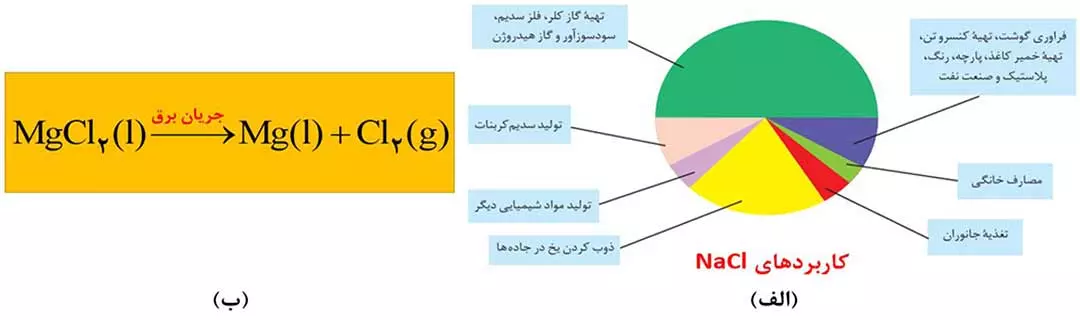
- بیشترین کاربرد NaCl، در تهیۀ گاز کلر، فلز سدیم، سود سوزآور (NaOH) و گاز هیدروژن است. کمترین کاربرد آن هم در مصارف خانگی می باشد. ( شکل 3 )
- منیزیم در آب دریا به شکل Mg 2+(aq) وجود دارد. برای استخراج و جداسازی آن نیز مراحل زیر انجام می شود:
- منیزیم را به صورت مادۀ جامد و نامحلول منیزیم هیدروکسید (Mg(OH)2) رسوب می دهند.
- رسوب به دست آمده را به منیزیم کلرید (MgCl2) تبدیل می کنند.
- منیزیم کلرید را ذوب کرده و سپس با استفاده از جریان برق، منیزیم کلرید مذاب را به عنصرهای سازندۀ آن تجزیه می کنند.
پایان بخش 2 آموزش شیمی دهم فصل 3. کاری از سایت جستجوی معلم خصوصی استادلینک.
مقالات مرتبط فصل3 شیمی1
بخش صفر – اهمیت شیمی در کنکور سراسری
بخش اول – منابع آب کرۀ زمین – یون های چنداتمی



















