این بخش آموزش شیمی شامل قسمت های زیر است:
1- مقدمه
2- یون های موجود در آب دریا
3- منابع آب در کرۀ زمین
4- شناسایی یون ها
5- یون های چند اتمی
1- مقدمه بر آموزش خط به خط شیمی فصل3
| دانلود جزوه تمامی فرمول های شیمی |
نزدیک به 75% سطح زمین را آب پوشانده است؛ به همین دلیل زمین از فضا به رنگ آبی دیده می شود.
توجه: جملۀ بالا دارای دو دام است. اول اینکه گفتیم 75% از سطح زمین نه 75% از کل زمین یا 75% از جرم زمین. دوم اینکه گفتیم آب نه آب آشامیدنی! چون بخش زیادی از این 75% اصلاً آب آشامیدنی نیست مانند آب اقیانوس ها و دریاها.
جرم کل آب روی کرۀ زمین در حدود 1/5 در 10 به توان 18 تن برآورد شده است؛ به طوری که اگر کرۀ زمین را مسطح در نظر بگیریم، آب همۀ سطح آن را تا ارتفاع 2 کیلومتر می پوشاند.
بخش عمدۀ این آب در اقیانوس ها و دریاها توزیع شده است. آب اقیانوس ها و دریاها مخلوطی همگن است. که اغلب مزه ای شور دارد؛ زیرا مقدار قابل توجهی از انوع نمک ها در آن حل شده است. گفته می شود که 5 در 10 به توان 16 تن نمک در آب اقیانوس ها و دریاها وجود دارد.
جرم کل مواد حل شده در آب های کرۀ زمین تقریباً ثابت است. از آنجا که سالانه میلیاردها تن مواد گوناگون از سنگ کره وارد آب کره می شود، پس باید همین مقدار ماده نیز از آب کره و به ویژه آب دریاها و اقیانوس ها خارج شود.
کرۀ زمین را می توان سامانه ای بزرگ در نظر گرفت که شامل چهار بخش هواکره، آب کره، سنگ کره، و زیست کره است. درون این سامانه و بین اسن چهار بخش، پیوسته مواد گوناگونی مبادله می شود؛ به همین دلیل گفته می شود زمین از دیدگاه شیمیایی پویاست یعنی بخش های گوناگون آن با یکدیگر برهم کنش های فیزیکی و شیمیایی دارند.
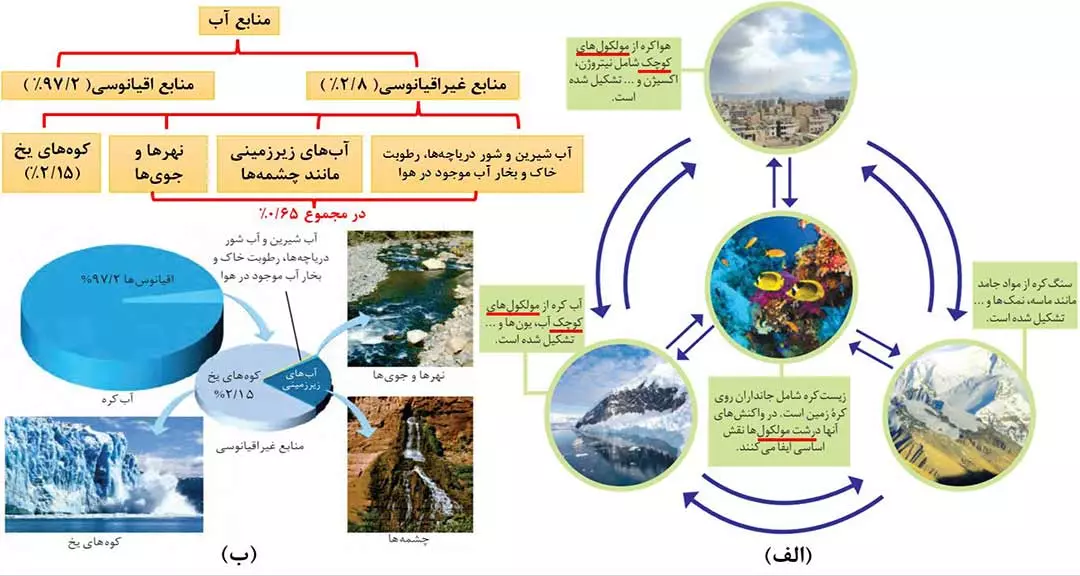
2- یون های موجود در آب دریا
منبع موجود در آب دریاها می تواند ناشی از فوران آتشفشان ها، فرسایش سطح کرۀ زمین، واکنش شیمیایی بین آب و پوستۀ زمین، انحلال گازهای موجود در هواکره و …. باشد.
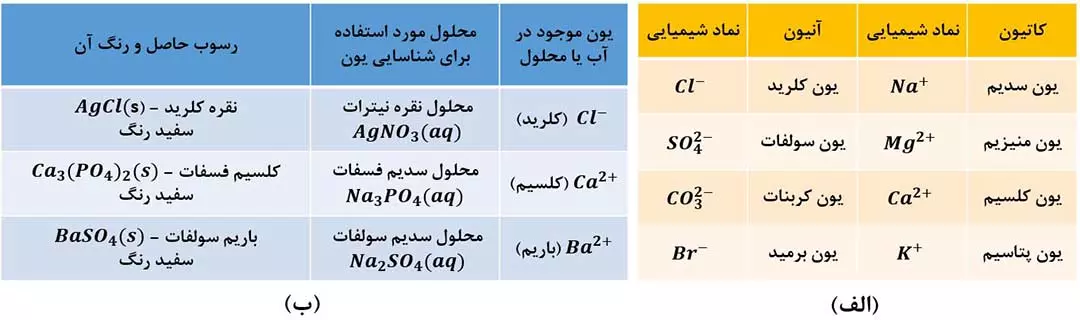
با توجه به جدول کتاب درسی، مطالب زیر را بخاطر بسپارید:
- کاتیون عنصرهای گروه های اول ( مانند +K و +Na ) و دوم ( مانند +2 Mg و +2 Ca ) جدول دروه ای در آب دریا وجود دارد.
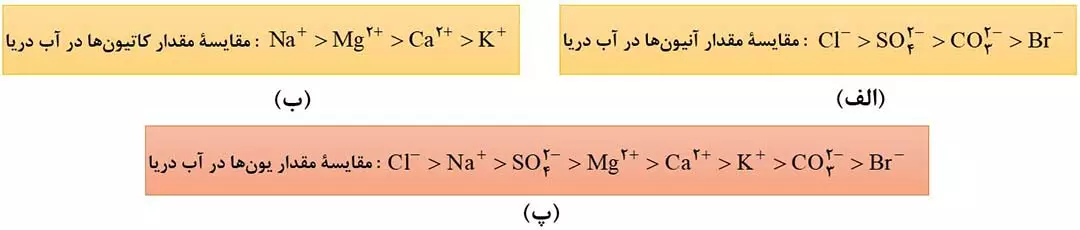
- مقدار یون کلرید از بقیۀ آنیون ها موجود در آب دریا بیشتر است. ( شکل 3 – الف )
- مقدار یون سدیم از بقیۀ کاتیون های موجود در آب دریا بیشتر است. ( شکل 3 – ب )
- بین همۀ کاتیون ها و آنیون ها، مقدار یون کلرید از همه بیشتر است. ( شکل 3 – پ )
- وجود انواع یون ها در آب دریا به دلیل انحلال نمک های گوناگون در آن است؛ به طور مثال انحلال سدیم کلرید (NaCl) باعث ورود همزمان یونهای سدیم و کلرید به آب دریا می شود. حل شدن ترکیبات یونی دیگری نیز مانند Na2SO4 یا Na2CO3 و NaBr هم باعث ورود یون +Na به آب دریا شده و از طرفی حل کردن ترکیبهای یونی مانند MgCl2 ، CaCl2 و KCl باعث ورود یون –Cl به آب دریا می شود.
3- منابع آب در کرۀ زمین
مطابق ( شکل 1 – ب )، منابع آب را می توان به دو دستۀ کلی، اقیانوسی و غیر اقیانوسی تقسیم کرد.
- حدود 77% منابع غیراقیانوسی آب را کوه های یخ تشکیل می دهند. ( شکل 4 – الف )
- مقایسۀ درصد فراوانی منابع آب غیراقیانوسی آب را در ( شکل 4 – ب ) مشاهده کنید.
- بیشتر آب های روی زمین شور است و نمی توان از آنها در کشاورزی و مصارف خانگی و صنعتی استفاده کرد.
- 50% جمعیت جهان از کم آبی رنج می برند.
- 66% از مردم جهان تا سال 2025 با کمبود آب مواجه خواهند شد.

4- شناسایی یون ها
دریاها مخلوطی همگن از انواع یون ها و مولکول ها در آب هستند. از آنجایی که آب هایی که به دریاها می ریزند، در مسیرهای خود از رمین هایی عبور می کنند که مواد شیمیایی گوناگونی دارند، نوع و مقدار مواد حل شده در دریاها با یکدیگر تفاوت دارد.
آب آشامیدنی برخلاف ظاهر زلال و شفافی که دارد، مانند آب دریاها ناخالص بوده و مخلوطی همگن حاوی مقدار کمی از یون های گوناگون مانند +Na و +2 Ca و +2 Mg و +2 Fe و –Cl و –OH و , -3 NO و –F و –42 SO است.
برخی از یون ها به طور طبیعی در آب حل شده اند و برخی دیگر مانند یون فلوئورید (–F)، در مراکز تامین آب آشامیدنی سالم، به آب افزوده می شوند. وجود مقدار بسیار کم یون فلوئورید در آب آشامیدنی باعث حفظ سلامت دندان ها می شود.
آب باران در هوای پاک تقریباً خالص است؛ زیرا هنگام تشکیل برف و باران، تقریباً همۀ مواد حل شونده در آب، از آن جدا می شوند. این فرایند الگویی برای تهیۀ آب خالص است که به آن فرایند « تقطیر » و فراوردۀ حاصل از آن را « آب مقطر » می گویند.
یکی از روش های شناسایی یون ها در آب یا محلول حاوی این یون ها، اضافه کردن یک ترکیب یونی دیگر به آنهاست؛ به طوری که با یون موردنظر ما رسوب (مادۀ نامحلول) تشکیل دهد. برای شناسایی یون های –Cl و +2 Ca و +2 Ba می توان به ترتیب از محلولهایی حاوی یون نقره (+Ag)، یون فسفات (–43 PO) و یون سولفات (–42 SO) استفاده کرد. ( شکل 2 – ب )
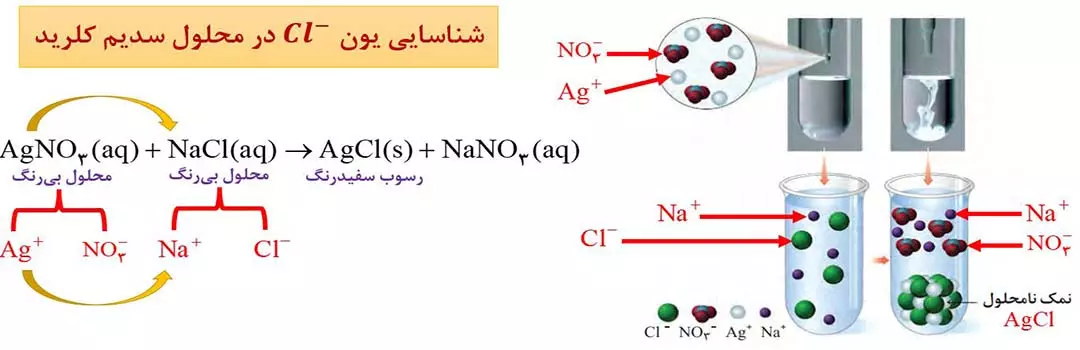

توجه: برای نوشتن یا کامل کردن معادلۀ واکنش هایی به فرم AB+CD —–> CB+AD ، کافی است جای دو عنصر فلزی در دو ترکیب را با رعایت قواعد فرمول نویسی عوض کنیم.

5- یون های چنداتمی
به یون هایی که از دو یا چند اتم یکسان یا متفاوت تشکیل شده باشند، یون های چنداتمی می گویند. مانند: –OH و –42 SO و +4 NH و –22 O و ….
در ساختار یون های چنداتمی، اتم ها با یکدیگر پیوند اشتراکی (کووالانسی) دارند. بار این یون ها به اتم خاصی تعلق ندارد بلکه متعلق به کل مجموعه است؛ به همین دلیل در واکنش ها به صورت یک واحد مستقل عمل می کنند. نبم و فرمول همۀ یون های چنداتمی که فعلاً باید بیاموزید در شکل زیر است.
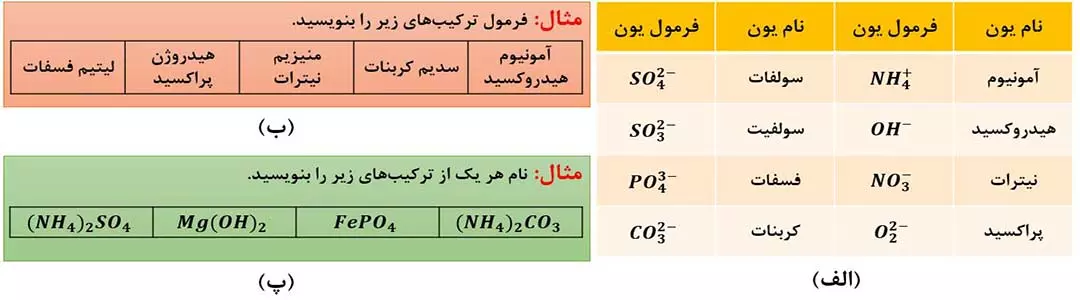
چند نکته:
1- گفتیم که در ساختار یون های چنداتمی، اتم ها با یکدیگر پیوند اشتراکی دارند؛ بنابراین می توان گفت در ترکیب های یونی دارای یون های چنداتمی، هر دو نوع پیوند یونی و اشتراکی وجود دارد.
2- ترکیب های یونی با انحلال در آب، به یون های سازنده تفکیک می شوند. بر اثر حل شدن هر واحد فرمولی از ترکیب های یونی انحلال پذیر در آب، به تعداد یون های سازنده، یون در آب ایجاد می شود.

توجه: برخی ترکیبات یونی مانند نقره کلرید، کلسیم فسفات و باریم سولفات در آب نامحلول اند؛ بنابراین نمی توانیم بگوییم بر اثر انحلال 1 مول از هر یک از این ترکیب ها در آب، به ترتیب 2 و 5 و 2 مول یون ایجاد می شود.
3- آمونیوم سولفات یکی از کودهای شیمیایی است که دو عنصر نیتروژن و گوگرد را در اختیار گیاه می گذارد. همانطور که می بینید، هر چهار عنصر سازندۀ این ترکیب یونی، نافلزند.
تمرین: ساختار لووییس یون های ( شکل 8 – الف ) را رسم کنید.
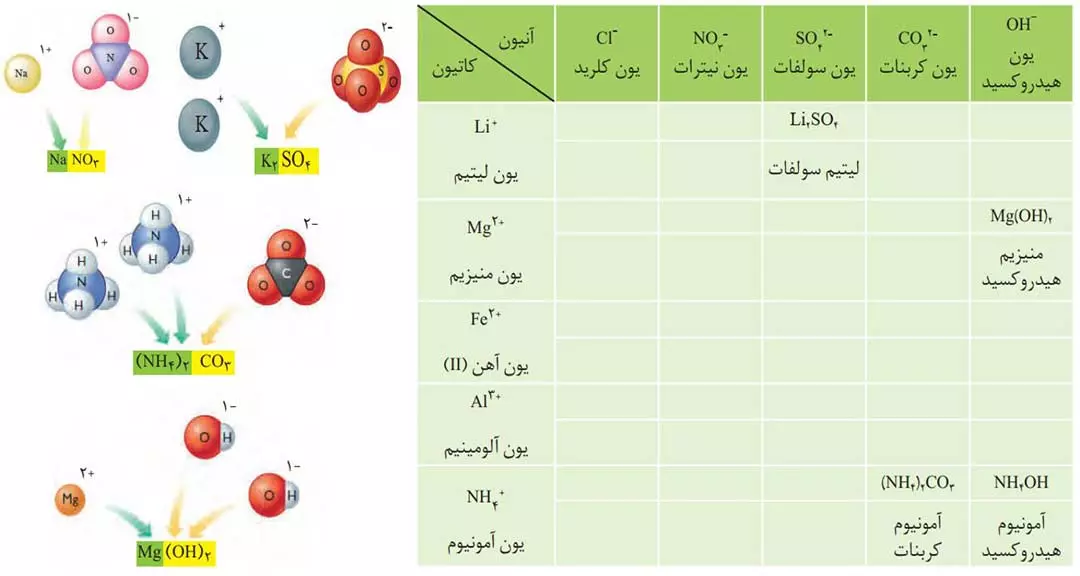
تمرین: جدول بالا را کامل کنید.
توجه: با توجه به شکل بالا و مدل فضا پرکن یون ها، یون سولفات و یون آمونیوم برخلاف یون نیترات، ساختار مسطح ندارند.
پایان بخش 1 فصل 3 آموزش خط به خط شیمی دهم به زبان ساده. کاری از سایت معلم خصوصی استادلینک
مقالات مرتبط فصل3 شیمی1
بخش صفر – اهمیت شیمی در کنکور سراسری
بخش دوم – قسمت در میلیون – درصد جرمی – مولاریته
بخش سوم – انحلال پذیری – استوکیومتری در محلول ها
بخش چهارم – مولکول های قطبی و ناقطبی – پیوند هیدروژنی



















