بخش 3 فصل 1 آموزش خط به خط شیمی یازدهم شامل موارد زیر می باشد:
- جدول ژانت و مقایسۀ آن با جدول تناوبی
- عنصرها به چه شکلی در طبیعت یافت می شوند؟
- شناسایی یون های آهن
- مقایسۀ واکنش پذیری عنصرها
- استخراج فلزها
- جریان فلز بین محیط زیست و جامعه
توجه: تهیه و گردآوری مطالب این آموزش توسط اساتید شیمی سایت تدریس خصوصی استادلینک انجام شده و استفاده از مطالب آن با ذکر نام منبع ( سایت استاد لینک ) بلامانع می باشد.
| دانلود جزوه تمامی فرمول های شیمی |
12- جدول ژانت | آموزش خط به خط شیمی یازدهم
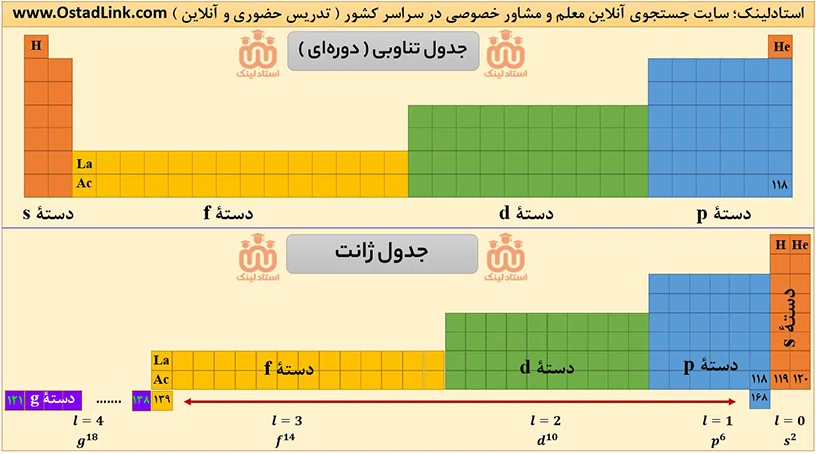
ویژگی های جدول ژانت
در این بخش از آموزش خط به خط شیمی یازدهم سایت استادلینک، تمامی ویژگی های جدول ژانت را مورد بررسی قرار داده ایم.
ویژگی های جدول ژانت
- عنصرهای دستۀ s سمت راست چیده شده است.
- عنصرهای دستۀ p بعد از دستۀ s قرار گرفته اند و پس از آن به ترتیب عنصرهای دستۀ d و f قرار گرفته اند.
- در جدول ژانت، تشخیص دشتۀ عنصرها راحت است.
- ترتیب افزایش عدد اتمی رعایت شده است.
- روند فلزی، نافلزی و شبه فلزی رعایت نشده است.
- مکان و دسته های عنصرهای 119 و 120 درست تعیین شده است و دو عنصر در دستۀ s قرار دارند.
- چیدن 50 عنصر جدید امکان پذیر است.
- در ردیف های پایین جدول ژانت، تقسیم بندی وجود ندارد.
- پیش بینی کرده که عنصر 121 به دستۀ جدید به نام g تعلق دارد.
- دستۀ g از عنصر 121 تا 138 ادامه دارد و عنصر 139 متعلق به دستۀ f است.
- عنصر 139 رفتاری شبیه عنصرهای 57 و 89 خواهد داشت.
- در این دسته بندی شماره گروه عنصرها نظمی ندارند و مشخص نیست بر چه اساسی است.
- دستۀ g در خود 18 عنصر قرار می دهد.
13- عنصرها به چه شکلی در طبیعت یافت می شوند؟
اغلب عنصرها به دلیل اینکه واکنش پذیرند، در طبیعت به شکل ترکیب وجود دارند. به طور مثال عنصر کلسیم به صورت کانی کلسیم کربنات (CaCO3) ، عنصر سدیم به صورت کانی سدیم کلرید (NaCl) ، عنصر منگنز به صورت کانی منگنز (II) کربنات (MnCO3) ، و آهن به صورت اکسیدهای آهن (اغلب Fe2O3) در طبیعت یافت می شوند.
توجه: برخی نافلزها و فلزها در طبیعت به شکل آزاد یعنی عنصری وجود دارند؛ نافلزهایی مانند اکسیژن (O2) ، نیتروژن (N2) ، گوگرد ( یه صورت کانی زردرنگ S8 ) و همۀ گازهای نجیب و فلزهایی مانند نقره، مس، پلاتین و طلا!
در میان فلزها، تنها طلا به شکل کلوخه ها یا رگه های زردرنگ در لا به لای خاک یافت می شود.
توجه: برخی فلزها مانند نقره و مس در طبیعت هم به صورت آزاد و هم به شکل سنگ معدن در ترکیب با نافلزها وجود دارند؛ به طور مثال در صفحۀ 48 تمرین 7 کتاب شیمی یازدهم چاپ 1401، می خوانیم که یکی از سنگ معدن های فلز مس، Cu2S ( مس (I) سولفید ) است.
14- فیلم آموزش شناسایی یون های آهن | آموزش شیمی یازدهم
در آموزش خط به خط شیمی دهم فصل 3، راههای شناسایی یون نقره (+Ag)، باریم (+2 Ba) و کلسیم (+2 Ca) را شناختیم. در این بخش می خواهیم با روش شناسایی دو یون پایدار آهن آشنا شویم.
آهن (26Fe) یکی از فلزهای دستۀ d جدول تناوبی ( ردیف 4 گروه 8 ) است که در جهان بیشترین مصرف سالانۀ فلزها را در بین صنایع گوناگون دارد. آهن ذز طبیعت اغلب به شکل اکسید فلز یافت می شود.
15- مقایسۀ واکنش پذیری عنصرها
واکنش پذیری هر عنصر به معنای تمایل آن به انجام واکنش شیمیایی است. هر چه واکنش پذیری اتم های عنصری بیشتر باشد، در شرایط یکسان تمایل آن برای انجام واکنش و تبدیل شدن به ترکیب بیشتر است.
در هر واکنش شیمیایی که به طور طبیعی انجام می شود، واکنش پذیری فراورده ها از واکنش دهنده ها کمتر است؛ پس اگر یک واکنش به ما بدهند که در دو طرف آن یک عنصر آزاد وجود داشته باشد و گفته شود که این واکنش به طور طبیعی انجام می شود، خیلی سریع می توانیم واکنش پذیری دو عنصر آزاد را مقایسه کنیم:

نکته: از آهن مذاب بدست آمده در واکنش ترمیت برای جوش دادن خطوط راه آهن استفاده می شود.
تمرین 1: ( آموزش خط به خط شیمی یازدهم )
کدام یک از واکنش های زیر به طور طبیعی انجام می شود؟ در صورت انجام شدن، طرف دوم آنها را نوشته و معادله را موازنه کنید.

تمرین 2: ( آموزش خط به خط شیمی یازدهم )
واکنش های زیر، واکنش های معروف در شیمی یازدهم هستند که بهتر است آنها را حتماً به خاطر بسپارید. برای هر بخش مقایسۀ خواسته شده را انجام دهید.

واکنش های بالا در صنعت برای استخراج آهن از سنگ آهن به کار می آیند که در آن ردپای کربن دی اکسید مشاهده می شود. با توجه به تصویر، واکنش پذیری آهن و کربن را مقایسه کنید.
توجه: در فولاد مبارکه مانند همۀ شرکت های فولاد جهان، برای استخراج آهن از کربن استفاده می شود.
یادآوری: از Fe2O3 به عنوان رنگ قرمز در نقاشی استفاده می شود.
نکته: به سنگ آهن ناخالص (Fe2O3) هماتیت و به سنگ معدن آلومینیوم (Al2O3) بوکسیت گفته می شود.
برای تهیۀ سیلیسیم ( عنصر اصلی سازندۀ سلول های خورشیدی ) از واکنش بالا استفاده می شود. واکنش پذیری سیلیسیم و کربن را مقایسه کنید.

تیتانیم، فلزی محکم، کم چگال و مقاوم در برابر خوردگی بوده و یکی از کاربردهای آن استفاده در بدنۀ دوچرخه است. یا ویژگی های دیگر این فلز ارزمشند در آموزش خط به خط شیمی دوازدهم سایت تدریس خصوصی استادلینک آشنا می شوید.
با توجه به واکنش بالا، واکنش پذیری تیتانیم و منیزیم را مقایسه کنید.

واکنش بالا یکی از روش های استخراج آهن است که روشی صنعتی نیست. با توجه به آن قدرت واکنش پذیری آهن و تیتانیم را مقایسه کنید.

یکی از روش های استخراج برخی از فلزها از سنگ معدن، حرارت دادن آنها در هوا ( اکسیژن ) است؛ به طور مثال برای استخراج فلز مس از Cu2S، سنگ معدن را در هوا حرارت می دهند تا واکنش بالا انجام شود.
در معدن مس سرچشمۀ کرمان، از همین واکنش برای تهیۀ مس خام از سنگ معدن Cu2S استفاده می شود. با توجه به واکنش بالا، واکنش پذیری گوگرد و گاز اکسیژن را با هم مقایسه کنید.
16- استخراج فلزها | آموزش شیمی یازدهم
فلزها از جمله هدایای زمینی هستند که اغلب در طبیعت به شکل سنگ معدن یافت می شوند. هر چه یک فلز فعال تر باشد، میل بیشتری به ایجاد ترکیب دارد؛ از این رو هر چه واکنش پذیری فلزی بیشتر باشد، استخراج آن فلز دشوارتر است.
برای استخراج یک فلز از ترکیب آن، باید از واکنش آن ترکیب با عنصری که واکنش پذیری بیشتری دارد، استفاده کرد. نمونه های آن را در تمرین 1 و 2 مساهده می کنید.
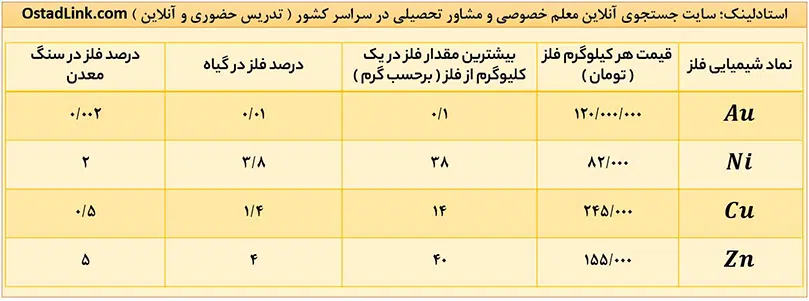
روش گیاه پالایی | آموزش خط به خط شیمی یازدهم
همانطور که می بینید، درصد فلزهای طلا (Au) و مس (Cu) در گیاه از درصد آنها در سنگ معدن خیلی بیشتر است؛ بنابراین با توجه به قیمت و پرکاربرد بودن این فلزها، روش گیاه پالایی برای استخراج این دو فلز مقرون به صرفه است.
برای فلز روی (Zn) درصد فلز در گیاه کمتر از درصد آن در سنگ معدن است؛ بنابراین استخراج آن به این روش مقرون به صرفه نیست.
برای فلز نیکل (Ni) با اینکه درصد فلز در گیاه بیشتر از سنگ معدن است، اما طبق نظر موفلین کتاب شیمی یازدهم، با توجچه به حجم گیاه مصرفی و … استخراج نیکل به روش گیاه پالایی مقرون به صرفه نیست.

بستر اقیانوس ها منبع غنی از منابع فلزی گوناگون است؛ طبق گفتۀ کتاب درسی شیمی یازدهم « غلظت بیشتر گونه های فلزی موجود در کف اقیانوس نسبت به ذخایر زمینی، بهره برداری از این منابع را نوید می دهد. »
مقایسه یون های موجود در آب دریا
17- جریان فلز بین محیط زیست و جامعه
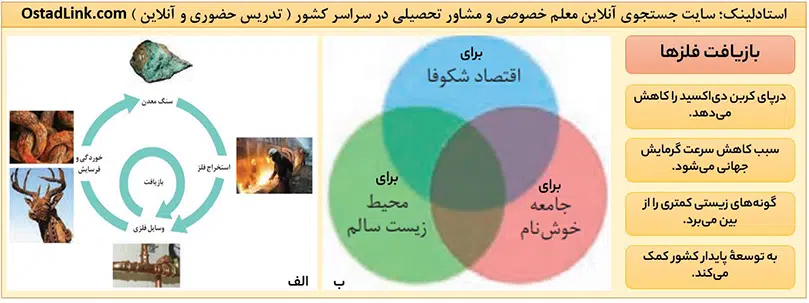
شکل بالا ( الف )، فرایند استخراج فلز از طبیعت و برگشت آن به طبیعت را نشان می دهد. همانطور که می بینید گردش فلز در طبیعت، چرخه ای را ایجاد می کند که در آن فلز از سنگ معدن استخراج می شود و سپس از این فلزها، ابزار، وسایل و مواد مختلفی تهیه می شود. در نهایت فلزها از طریق فرسایش و زنگ زدن ( خوردگی ) به طبیعت بازگشته و تبدیل به سنگ معدن می شوند.
توجه: فرآیند فرسایش و خوردگی فلزها به کندی انجام می شود؛ بنابراین مدت زمان بسیار طولانی نیاز است تا این مرحله انجام شود و چرخۀ فلز کامل گردد؛ بنابراین آهنگ مصرف و استخراج فلز با آهنگ برگشت فلز به طبیعت به شکل سنگ معدن، یکسان نیست.
فلزها جزء منابع تجدیدناپذیرند؛ زیرا این منابع پس از استفاده با تشکیل دوباره، جایگزین نمی شوند. به عبارت دیگر سرعت تشکیل و جایگزین شدن آنها آنقدر آهسته است که تأثیر چندانی برای جبران منابع ندارد.
در سال دهم خواندیم توسعۀ پایدار یعنی اینکه در تولید یک ماه با عرضۀ خدمات، همۀ هزینه ها و ملاحظه های اقتصادی، اجتماعی و زیست محیطی در نظر گرفته شود. حالا اگر مجموع هزینه های بهره برداری از یک معدن با در نظر گرفتن این ملاحظه ها، کمترین مقدار مقدار ممکن باشد، در آن صورت در مسیر پیشرفت پایدار حرکت می کنیم؛ یعنی رفتارهای ما، آسیب کمتری به محیط زیست وارد می کند.
به عبارت دیگر ردپای زیست محیطی ما را کاهش می دهد. یکی از روش هایی که به توسعۀ پایدار کشور کمک می کند، بازیافت فلزها است.
نکتۀ مهم: از بازگردانی هفت قوطی فولادی آنقدر انرژی ذخیره میشود كه میتوان یك لامپ 60 واتی را در حدود 25 ساعت روشن نگه داشت.
نکتۀ مهم: در استخراج 1000 کیلوگرم آهن، تقریباً 2000 کیلوگرم سنگ معدن آهن و 1000 کیلوگرم از منابع معدنی دیگر استفاده می شود.
دانلود نمونه سوالات امتحانی شیمی یازدهم
تدریس خصوصی شیمی در اصفهان

برای موفقیت در امتحانات شیمی یازدهم، شیمی کنکور و امتحان نهایی شیمی، می توانید از کلاس های خصوصی شیمی سایت تدریس خصوصی استادلینک استفاده نمایید.
استادلینک با داشتن بهترین اساتید دروس مختلف در سراسر کشور و همچنین برگزاری کلاس های حضوری و آنلاین و ارائه بهترین خذمات با مناسب ترین هزینه، همواره در کنار شما دانش آموزان و داوطلبان کنکور سراسری است.
برای آگاهی از شرایط ثبت نام و جزئیات بیشتر به پشتیبانی سایت تدریس خصوصی استادلینک پیام دهید تا به شما مشاوره مناسب داده شود.
مقالات مرتبط فصل 1 آموزش شیمی یازدهم
با کلیک بر روی هر بخش زیر، می توانید به آموزش خط به حط شیمی یازدهم بخش های مختلف فصل 1 دسترسی داشته باشید.




















