بخش 2 فصل 1 آموزش خط به خط شیمی یازدهم شامل موارد زیر می باشد:
- شعاع اتمی و روند تغییر آن در جدول دوره ای
- رابطۀ واکنش پذیری و خصلت فلزی و نافلزی با شعاع اتمی
- آشنایی با فلزهای گروه اول و دوم جدول دوره ای
- هالوژن ها
- عنصرهای دستۀ d
- طلا
6- شعاع اتمی و روند تغییر آن در جدول تناوبی
| دانلود جزوه تمامی فرمول های شیمی |
بر اساس مدل کوانتومی، اتم را مانند کره ای در نظر می گیرند که الکترون های اطراف هسته و در لایه های الکترونی در حال حرکت هستند؛ به همین دلیل می توان برای هر اتم، شعاعی در نظر گرفت.
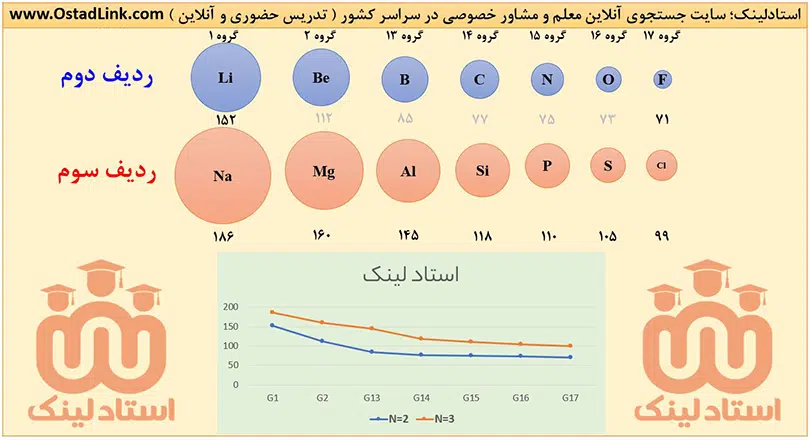
1- در یک گروه از بالا به پایین با افزایش تعداد لایه های الکترونی، شعاع اتمی افزایش می یابد.
2- در یک دوره از چپ به راست، شعاع اتمی عنصرها، کاهش می یابد؛ زیرا از چپ به راست با افزایش عدد اتمی، تعداد پروتون ها و بار مثبت هسته زیاد می شود، در حالی که تعداد لایه های الکرتونی ثابت است؛ در نتیجه نیروی جاذبۀ هسته بر الکترون های ظرفیت افزایش می یابد و این الکترون ها با نیروی قوی تری به سمت هسته جذب می شوند؛ بنابراین شعاع اتمی، کاهش می یابد.
جمع بندی تغییر شعاع عناصر در جدول تناوبی | آموزش شیمی یازدهم
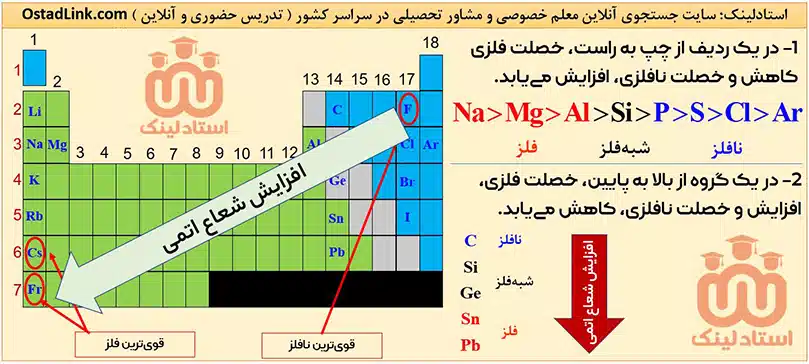
با توجه به روند تغییر شعاع اتمی در یک گروه و دوره، هر چه عنصری در جدول دوره ای، سمت چپ تر و پایین تر باشد، شعاع آن بیشتر است و برعکس! هر چه عنصری، سمت راست تر و بالاتر باشد، شعاع آن کمتر است.
7- رابطۀ واکنش پذیری و خصلت فلزی و نافلزی با شعاع اتمی
این بخش از آموزش خط به خط شیمی یازدهم بسیار مهم و تست خیز بوده و در امتحانات شیمی یازدهم و سوالات کنکور شیمی همواره مطرح می شود.
1- در گروه ها | آموزش شیمی یازدهم
به طور کلی واکنش پذیری و خصلت فلزی با شعاع اتمی در فلزها رابطۀ مستقیم دارد؛ زیرا با افزایش شعاع اتمی، فلز راحت تر الکترون از دست می دهد و در نتیجه واکنش پذیری آن بیشتر می شود
برای اغلب نافلزها، واکنش پذیری و خصلت نافلزی با شعاع اتمی رابطۀ وارونه دارد؛ زیرا هر چه شعاع اتمی بیشتر شود، نافلز سخت تر الکترون می گیرد.

2- در دوره ها | آموزش شیمی یازدهم
در عنصرهای فلزی یک دوره، از چپ به راست، به دلیل کاهش شعاع اتمی، تمایل فلز برای از دست دادن الکترون کم تر شده؛ یعنی خصلت فلزی و واکنش پذیری کاهش می یابد.

در عنصرهای نافلزی یک دوره، از چپ به راست، به دلیل کاهش شعاع اتمی، تمایل نافلز برای گرفتن الکترون بیشتر می شود؛ یعنی خصلت نافلزی و واکنش پذیری افزایش می یابد.

با توجه به توضیحات بالا، نمودار تقریبی واکنش پذیری عنصرهای دورۀ سوم را می توان به صورت زیر نمایش داد:
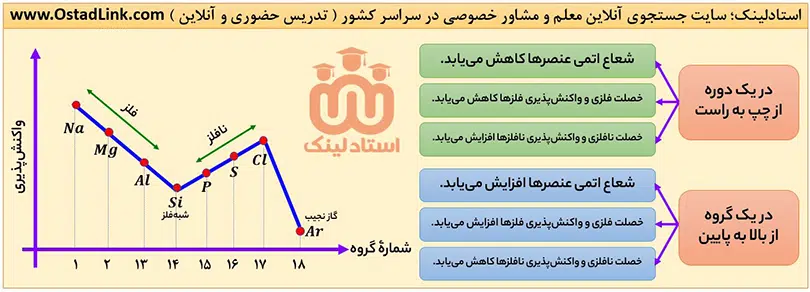
توجه: روندهای گفته شده در این قسمت، فقط مربوط به عنصرهای دستۀ s و p بود. جلوتر خواهیم دید که واکنش پذیری عنصرهای دستۀ d از این روند پیروی نمی کند.
6- آشنایی با فلزهای گروه اول و دوم جدول دوره ای
در این قسمت از آموزش خط به خط شیمی یازدهم با عنصر گروه اول و دوم جدول تناوبی آشنا می شویم. شایان ذکر است در کل به جز عناصر 1 تا 36، عناصر گروه 1، 2، 14 و 17 را به خوبی بشناسید.
1- فلزهای گروه اول | آموزش شیمی یازدهم
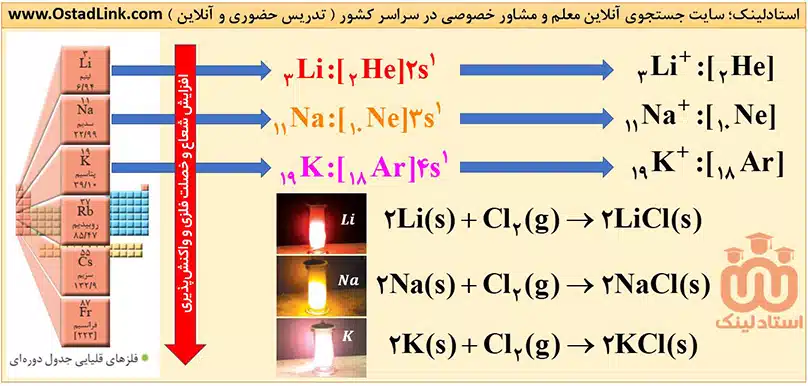
این فلزها به فلزهای قلیایی معروف اند و از فلز لیتیم (3Li) در دورۀ دوم شروع شده و به فلز فرانسیم (87Fr) در دورۀ هفتم ختم می شوند. ( قلیا به معناز “باز” است )
آرایش الکترونی عناصر این گروه به ns1 ختم می شود. در واقع این فلزها در بیرونی ترین لایۀ الکترونی خود، تنها یک الکترون دارند.
این فلزها با از دست دادن تنها یک الکترون و تبدیل شدن به یون +M به آرایش الکترونی پایدار گاز نجیب قبل از خود می رسند؛ به همین دلیل بسیار واکنش پذیرند و در طبیعت به حالت آزاد یافت نمی شوند. به طور مثال جلای نقره ای فلز سدیم در مجاورت هوا به سرعت از بین می رود و سطح آن کدر می شود.
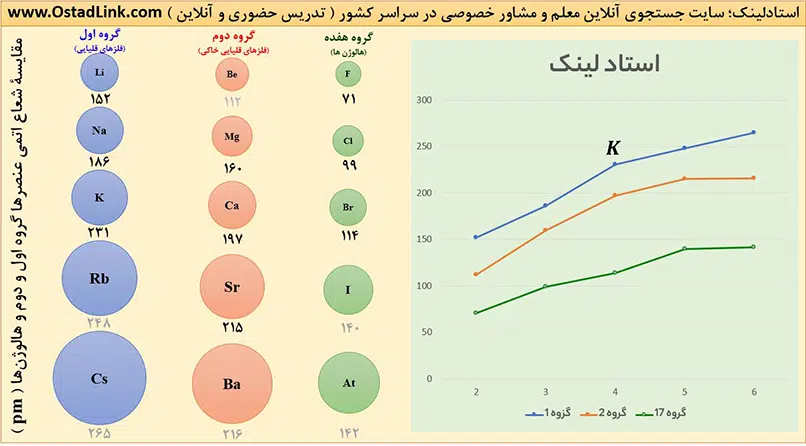
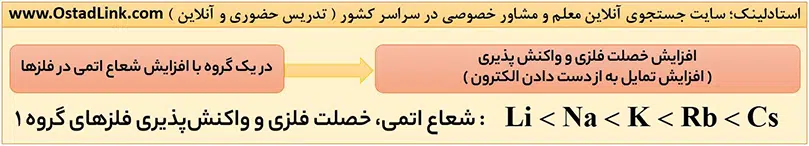
خصلت فلزی و واکنش پذیری (فعالیت) فلزهای قلیایی از بالا به پایین با افزایش شعاع اتمی، افزایش می یابد.
Li<Na<K<Rb<Cs<Fr : شعاع اتمی و واکنش پذیری ( خصلت فلزی )
توجه: تولید نور، آزادسازی گرما، تشکیل رسوب و خروج گاز نشانه هایی از تغییر شیمیایی هستند. هر چه شدت نور یا آهنگ خروج گاز آزاد شده بیشتر باشد، واکنش شیمیایی سریع تر و شدیدتر است و واکنش دهنده، فعالیت شیمیایی بیشتری دارد.
2- فلزهای گروه دوم | آموزش شیمی یازدهم
این فلزها به فلزهای قلیایی خاکی معروف اند و از فلز بریلیم () در دورۀ دوم شروع شده و به فلز رادیم () در دورۀ هفتم ختم می شوند.
آرایش الکترونی عنصرهای این گروه به ns2 ختم می شود؛ یعنی این عنصرها در بیرونی ترین لایۀ خود، دو الکترون دارند.
این فلزها ( به جز بریلیم که یون تشکیل نمی دهند ) با از دست دادن 2 الکترون و تبدیل شدن به کاتیون + M2 به آرایش الکترونی پایدار گاز نجیب قبل از خود می رسند.
در این گروه از بالا به پایین با افزایش شعاع اتمی، خصلت فلزی و واکنش پذیری افزایش می یابد.
Be<Mg<Ca<Sr<Ba<Ra : شعاع اتمی و واکنش پذیری ( خصلت فلزی )
از آنجا که در یک دوره از چپ به راست، شعاع اتمی کاهش می یابد، واکنش پذیری ( خصلت فلزی ) فلزهای قلیایی خاکی از فلزهای قلیایی هم دورۀ خود، کمتر است.
9- هالوژن ها | آموزش شیمی یازدهم
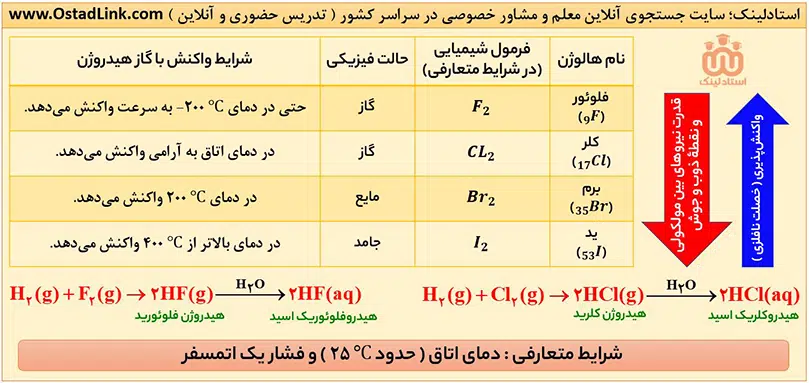
چند نکته در مورد هالوژن ها:
- عنصرهای گروه 17 جدول تناوبی را هالوژن می نامند. عناصری که در تصویر بالا آمده همگی نافلز هستند.
- آرایش الکترونی عنصرهای این گروه به ns2np5 ختم می شود. در واقع این عنصرها در لایۀ ظرفیت خود، 7 الکترون دارند.
- هالوژن ها، واکنش پذیرترین نافلزهای یک دوره هستند. اتم این عنصرها، هم با به اشتراک گذاشتن و هم با گرفتن الکترون می توانند به آرایش پایدار گاز نجیب برسند.
- این عنصرها با گرفتن یک الکترون به یون هالید (–X) تبدیل می شوند.
- در تولید لامپ های جلوی خودرو، از هالوژن ها استفاده می شوند.
- هالوژن ها به آسانی با فلزها، به ویژه فلزهای قلیایی، واکنش می دهند و نمک ها ( ترکیب های یونی ) را می سازند.
2Na(s)+Cl2(g)——>2NaCl(s)
10- عنصرهای دسته d
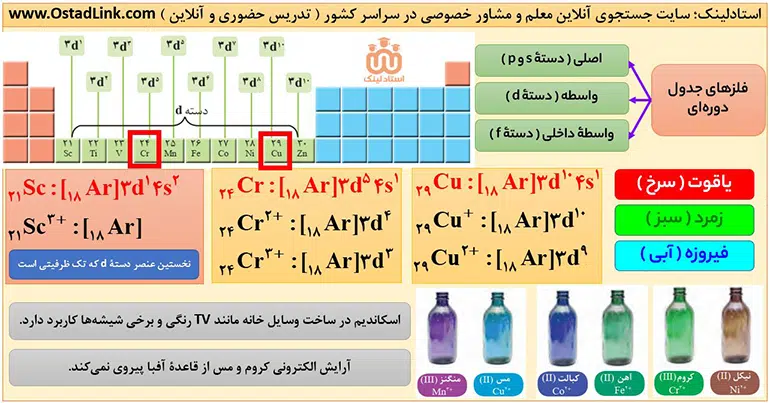
در سال دهم دیدیم که عنصرهای جدول دوره ای را براساس زیر لایه های در حال پر شدن به 4 دستۀ d,p,s و f تقسیم می کنند. عنصرهای دستۀ d همگی فلز هستند و در جدول تناوبی، بین فلزهای دستۀ s و p قرار گرفته اند؛ از این رو فلزهای دستۀ d به فلزهای واسطه هم معروف اند؛ فلزهای دستۀ s و p هم به فلزهای اصلی شهرت دارند.
چند نکته در مورد فلزهای واسطه
- اولین سری آنها از عنصر 21 تا 30 شروع می شود.
- فقط وانادیم تک حرفی است.
- فقط اسکاندیم و فلز روی تک ظرفیتی هستند.
- اغلب آنها در طبیعت به صورت آزاد ( عنصری ) یافت نمی شوند. ( مانند دو اکسید آهن یعنی FeO و Fe2O3 )
- رنگ سنگ های قیمتی و شیشه های رنگی، به دلیل وجود برخی کاتیون ها و ترکیب های فلزهای واسطه است.
- اغلب کاتیون های عنصرهای دسته d از قاعدۀ هشتایی پیروی نمی کنند و بدون رسیدن آرایش الکترونی گاز نجیب، به پایداری می رسند.
- ویژگی عمومی فلزها مانند چکش خواری، رسانایی گرما و حرارت و … را دارند.
توجه: کاتیون همۀ فلزهای دستۀ s و آلومینیوم ( تنها عنصر دستۀ p ) به گاز نجیب قبل از خود می رسند.
تمرین در خانه (H.W) | آموزش خط به خط شیمی یازدهم
آرایش الکترونی فشردۀ عناصر 1 تا 36 را به همراه یون های پایدار آنها ( کاتیون یا آنیون ) برای جلسۀ آینده نوشته و تحویل دهید.
11- طلا (Au) | آموزش شیمی یازدهم
طلا (79Au) فلزی ارزشمند و گرانبها از دستۀ d جدول تناوبی است که علاوه بر ویژگی های مشترک فلزها، ویژگی های منحصر به فردی نیز دارد. این عنصر در گروه 11 و دستۀ 6 جدول دوره ای قرار دارد.
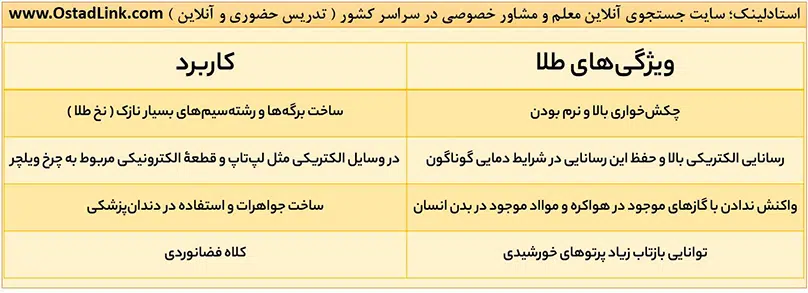
فلز طلا به دلیل پایداری شیمیایی بالا و واکنش پذیری بسیار کم، در طبیعت به شکل فلزی و عنصری ( به حالت آزاد ) یافت می شود؛ اما مقدار طلا در معادن آن بسیار کم است، به طوری که برای استخراج مقدار کمی از آن باید از حجم انبوهی خاک معدن استفاده کرد؛ به همین دلیل استخراج طلا با تولید پسماند زیادی همراه است و آثار زیان بار زیست محیطی را به دنبال دارد.
تدریس خصوصی شیمی در اصفهان

برای موفقیت در امتحانات شیمی یازدهم، شیمی کنکور و امتحان نهایی شیمی، می توانید از کلاس های خصوصی شیمی سایت تدریس خصوصی استادلینک استفاده نمایید.
استادلینک با داشتن بهترین اساتید دروس مختلف در سراسر کشور و همچنین برگزاری کلاس های حضوری و آنلاین و ارائه بهترین خذمات با مناسب ترین هزینه، همواره در کنار شما دانش آموزان و داوطلبان کنکور سراسری است.
برای آگاهی از شرایط ثبت نام و جزئیات بیشتر به پشتیبانی سایت تدریس خصوصی استادلینک پیام دهید تا به شما مشاوره مناسب داده شود.
مقالات مرتبط فصل 1 آموزش شیمی یازدهم
با کلیک بر روی هر بخش زیر، می توانید به آموزش خط به حط شیمی یازدهم بخش های مختلف فصل 1 دسترسی داشته باشید.



















